43.Электролиз. Законы электролиза
Электролиз — физико-химический процесс, состоящий в выделении на электродах составных частей растворённых веществ или других веществ, являющихся результатом вторичных реакций на электродах, который возникает при прохождении электрического тока через раствор, либо расплавэлектролита.
Упорядоченное движение ионов в проводящих жидкостях происходит в электрическом поле, которое создается электродами — проводниками, соединёнными с полюсами источника электрической энергии. Анодом при электролизе называется положительный электрод, катодом — отрицательный[1]. Положительные ионы — катионы — (ионы металлов, водородные ионы, ионы аммония и др.) — движутся к катоду, отрицательныеионы — анионы — (ионы кислотных остатков и гидроксильной группы) — движутся к аноду.
Явление
электролиза широко применяется в
современной промышленности.
В частности, электролиз является одним
из способов промышленного
получения алюминия, водорода,
а также гидроксида
натрия, хлора,
хлорорганических
соединений
Электролиз находит применение в очистке сточных вод (процессы электрокоагуляции, электроэкстракции, электрофлотации). Применяется для получения многих веществ (металлов, водорода, хлора и др.), при нанесении металлических покрытий (гальваностегия), воспроизведении формы предметов (гальванопластика).
Первый закон Фарадея
Первый закон электролиза Фарадея: масса вещества, осаждённого на электроде при электролизе, прямо пропорциональна количеству электричества, переданного на этот электрод. Под количеством электричества имеется в виду электрический заряд, измеряемый, как правило, в кулонах.
В 1832 году Фарадей установил,
что масса m вещества, выделившегося на
электроде, прямо пропорциональна
электрическому заряду q, прошедшему
через электролит: 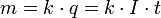 если
через электролит пропускается в течение
времени t постоянный ток с силой тока
I. Коэффициент
пропорциональности
если
через электролит пропускается в течение
времени t постоянный ток с силой тока
I. Коэффициент
пропорциональности 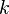 называется электрохимическим
эквивалентом вещества.
Он численно равен массе вещества,
выделившегося при прохождении через
электролит единичного электрического
заряда, и зависит от химической природы
вещества.
называется электрохимическим
эквивалентом вещества.
Он численно равен массе вещества,
выделившегося при прохождении через
электролит единичного электрического
заряда, и зависит от химической природы
вещества.
Вывод закона Фарадея
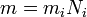
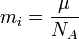 (2)
(2)
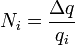 (3)
(3)
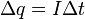 (4)
(4)
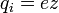 ,
где z — валентность атома (иона)
вещества, e — заряд
электрона (5)
,
где z — валентность атома (иона)
вещества, e — заряд
электрона (5)
Подставляя (2)-(5) в (1), получим
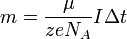
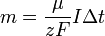
где 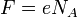 — постоянная
Фарадея.
— постоянная
Фарадея.
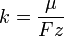
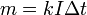
Второй закон Фарадея
Второй закон электролиза Фарадея: для данного количества электричества масса химического элемента, осаждённого на электроде, прямо пропорциональна эквивалентной массе элемента. Эквивалентной массой вещества является его молярная масса, делённая на целое число, зависящее от химической реакции, в которой участвует вещество.
Электрохимические эквиваленты различных веществ относятся, как их химические эквиваленты.
Химическим эквивалентом иона называется отношение молярной массы A иона к его валентности z. Поэтому электрохимический эквивалент
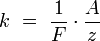
где 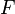 — постоянная
Фарадея.
— постоянная
Фарадея.
Второй закон Фарадея записывается в следующем виде:
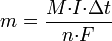
где 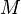 — молярная
масса данного
вещества, образовавшегося (однако не
обязательно выделившегося — оно
могло и вступить в какую-либо реакцию
сразу после образования) в результате
электролиза, г/моль;
— молярная
масса данного
вещества, образовавшегося (однако не
обязательно выделившегося — оно
могло и вступить в какую-либо реакцию
сразу после образования) в результате
электролиза, г/моль; 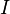 — сила
тока,
пропущенного через вещество или смесь
веществ (раствор, расплав), А;
— сила
тока,
пропущенного через вещество или смесь
веществ (раствор, расплав), А; 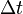 —
время, в течение которого проводился
электролиз, с;
—
время, в течение которого проводился
электролиз, с; 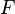 — постоянная
Фарадея,Кл·моль−1;
— постоянная
Фарадея,Кл·моль−1; 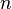 —
число участвующих в процессе электронов,
которое при достаточно больших значениях
силы тока равно абсолютной величине
заряда иона (и его противоиона), принявшего
непосредственное участие в электролизе
(окисленного или восстановленного).
Однако это не всегда так; например, при
электролизе раствора соли меди(II) может
образовываться не только свободная
медь, но и ионы меди(I) (при небольшой
силе тока).
—
число участвующих в процессе электронов,
которое при достаточно больших значениях
силы тока равно абсолютной величине
заряда иона (и его противоиона), принявшего
непосредственное участие в электролизе
(окисленного или восстановленного).
Однако это не всегда так; например, при
электролизе раствора соли меди(II) может
образовываться не только свободная
медь, но и ионы меди(I) (при небольшой
силе тока).
studfile.net
Законы электролиза Фарадея и их применение для расчета количественных характеристик процесса электролиза
Электролизомназывается совокупность электрохимических окислительно-восстановительных реакций, протекающих на электродах при прохождении постоянного электрического тока через раствор или расплав электролита. При этом на катоде происходит процесс восстановления, а на аноде – окисления. Катионы восстанавливаются в ионы более низкой степени окисления или в атомы, например:
Fe3+ + e – → Fe2+ ; (3.54)
Cu2+ + 2 e – → Cu. (3.55)
Нейтральные молекулы могут участвовать в превращениях на катоде непосредственно или взаимодействовать с продуктами катодного процесса, которые рассматриваются в этом случае как промежуточные вещества. Например, восстановление воды:
2 H2O + 2 e – → H2 + 2 OH–. (3.56)
На аноде окисляются ионы или молекулы, поступающие из объема электролита, например:
4 OH– – 4 e – → 2 H2O + H2; (3.57)
2 Cl– – 2 e – → Cl2,– (3.58)
или принадлежащие материалу анода. в последнем случае анод растворяется, например:
Cu – 2 e – → Cu2+ (растворение медного анода). (3.59)
Протекание электродных реакций зависит от состава и концентрации электролита, материала электродов, электродного потенциала, температуры, гидродинамических условий.
Процессы электролиза описываются законами Фарадея, которые в объединенной форме читаются следующим образом: массы веществ, испытавших электрохимические превращения на электродах, прямо пропорциональны количеству протекшего через электролит электричества и электрохимическим эквивалентам этих веществ:

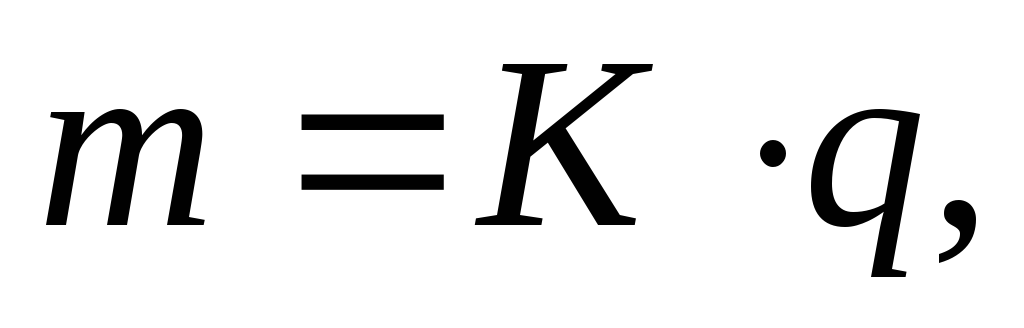 (3.60)
(3.60)где m – масса вещества, превратившегося на электроде (выделившегося на электроде),
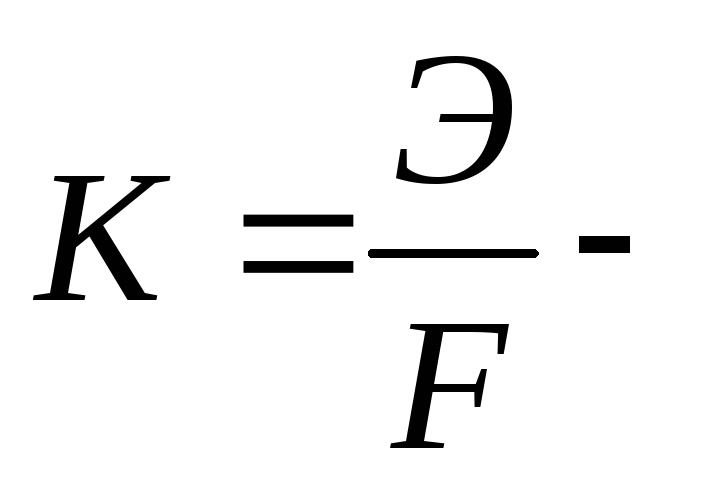 электрохимический
эквивалент – величина характеризующая массу
продуктов электролиза, выделившихся
на электродах при прохождении через
электролит 1 Кл электричества;
электрохимический
эквивалент – величина характеризующая массу
продуктов электролиза, выделившихся
на электродах при прохождении через
электролит 1 Кл электричества;
Э – химический эквивалент вещества (эквивалентная масса вещества) при окислительно-восстановительном превращении, г/экв;
q – количество прошедшего электричества, Кл;
F – число Фарадея (96485 Кл/г-экв) – количество электричества, необходимое для химического превращения (выделения на электроде) 1 г-экв вещества.
Так как q = I · τ (I – сила тока, А; τ – продолжительность электролиза, с), то уравнение закона Фарадея может быть записано следующим образом: 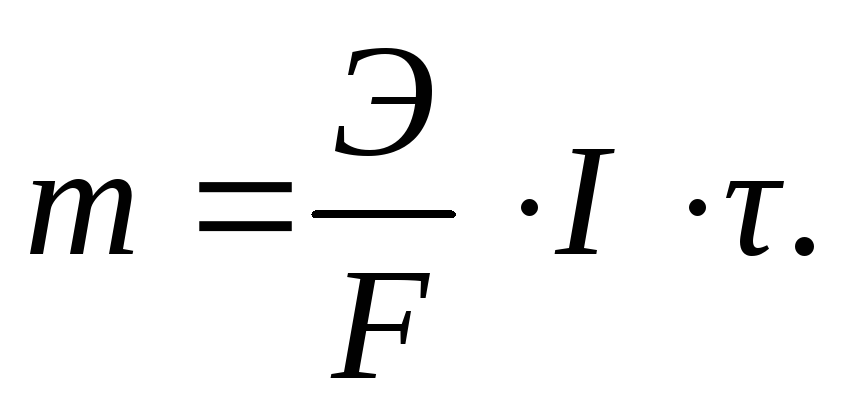 (3.61)
(3.61)
Химический эквивалент вещества (эквивалентная масса вещества) при окислительно-восстановительном превращении рассчитывается по формуле:
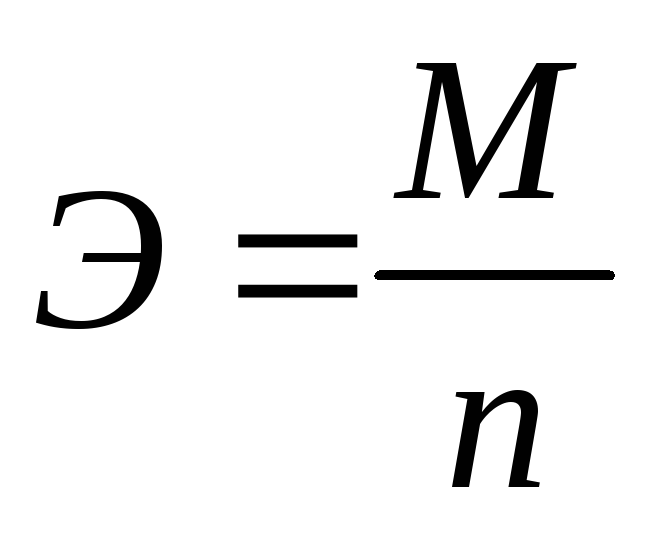 , (3.62)
, (3.62)
где М– молярная масса вещества, претерпевающего превращение на электроде, г/моль;
n– количество электронов, участвующих в одном акте химического превращения.
При электрохимических процессах часто наблюдаются отклонения от законов Фарадея: масса действительно полученного или разложившегося продукта не соответствует теоретической. Эти отклонения – кажущиеся и возникают за счет одновременного протекания побочных электрохимических процессов; химических реакций, в которые вступает продукт; потерь продукта и потерь электроэнергии на преодоление сопротивления электролизера. Эффективность электрохимического процесса оценивается
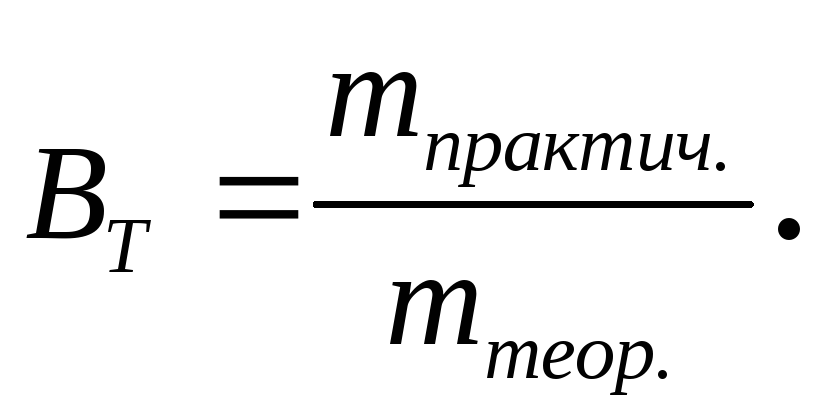 (3.63)
(3.63)
Эта величина может быть выражена в процентах:
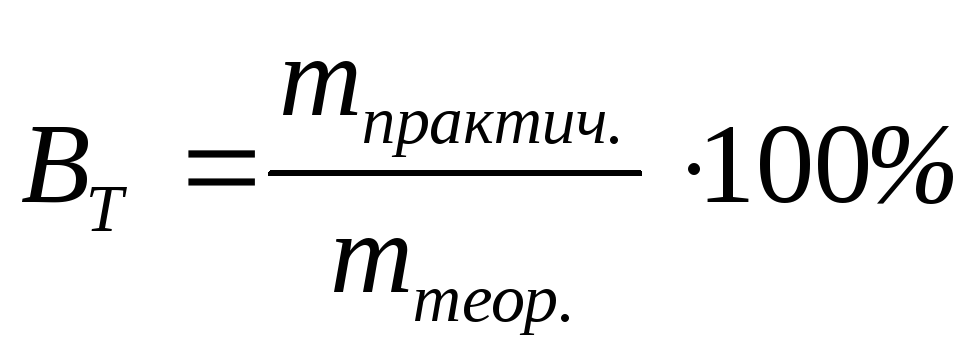 .
(3.64)
.
(3.64)
Тогда практическое количество вещества, образующееся при электролизе рассчитывается по формуле:
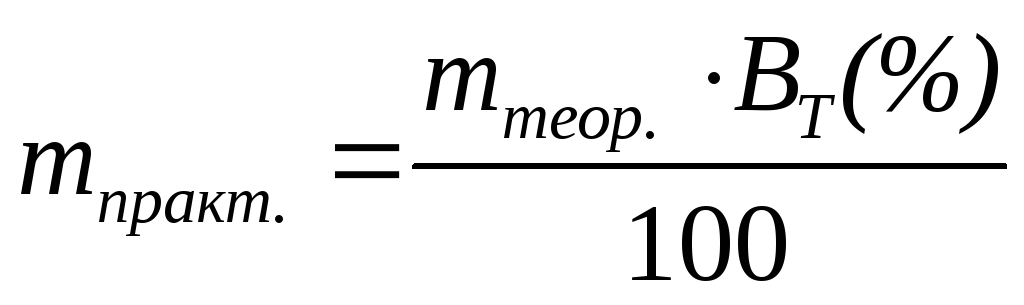 .
(3.65)
.
(3.65)
П р и м е р 3.18. Какое количество алюминия выделится при электролизе за время 12 ч, если сила тока I =2,5 A, а выход по току составляет 88 %. Молярная масса алюминия М, равная его грамм-атомной массе А, составляет 26,98 г/моль.
Р е ш е н и е
Выделение алюминия при электролизе происходит на катоде при прохождении следующей реакции восстановления:
Al3+ + 3 e – = Al; n = 3.
Химический эквивалент алюминия рассчитываем по формуле (3.62):
Э = М / 3 = 26,98 / 3 = 8,99 г/экв.
Продолжительность электролиза τ = 12 час = 12 · 3600 = 43200 с.
По объединенному закону Фарадея (3.61) находим теоретическое количество алюминия, выделяющееся при электролизе в указанных условиях:
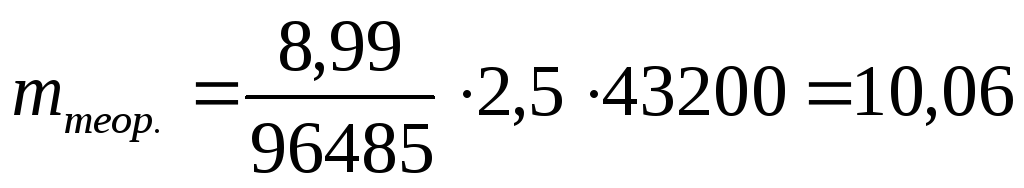 г.
г.
Практическое количество выделившегося при электролизе алюминия находим с учетом величины ВТ по формуле (3.65):

П р и м е р 3.19. Определить время, необходимое для выделения при электролизе 1,2 г меди, если сила тока I = 2 A, а выход по току ВТ = 96 %.
Р е ш е н и е
На основании формулы (3.64) находим, на какое теоретическое количество меди необходимо рассчитывать продолжительность электролиза:
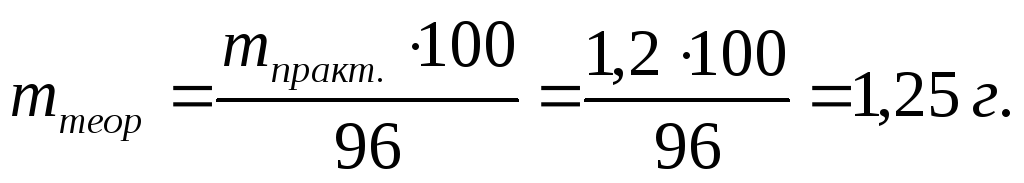
Выделение меди при электролизе происходит на катоде при прохождении следующей реакции восстановления:
Сu2+ + 2 e– = Cu; n = 2.
Химический эквивалент меди рассчитываем по формуле (3.62):
Э = М / 2 = 63,54 / 2 = 31,77 г/экв.
Из уравнения закона Фарадея (3.61) находим время процесса:
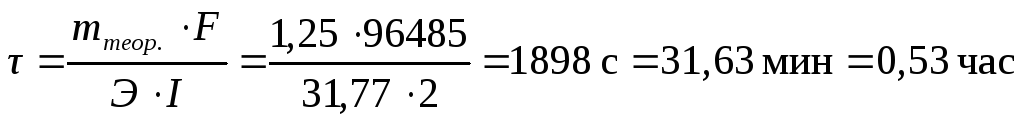
studfile.net
Законы электролиза
Процессы электролиза подчиняются законам Фарадея:
Первый закон:
Масса электролита, подвергшаяся химическому превращению, а также массы веществ, выделившихся на электродах, прямо пропорциональны количеству электричества, прошедшему через расплав или раствор электролита.
Второй закон:
При пропускании одинакового количества электричества через растворы или расплавы различных электролитов масса веществ, выделяющихся на электродах, пропорциональна их химическим эквивалентам.
Для расчетов используют объединенное уравнение законов Фарадея:
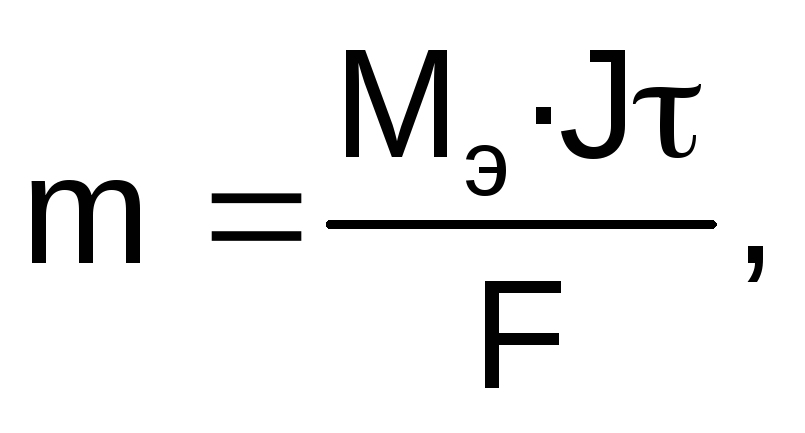
где m – масса электролита, подвергшаяся химическому превращению, или масса вещества, выделившегося на электроде, г; Мэ – молярная масса эквивалентов вещества, г/моль; J – сила тока, А; — время электролиза, с; F – число Фарадея (96500 Кл/моль).
Молярная масса эквивалентов вещества рассчитывается по формуле:
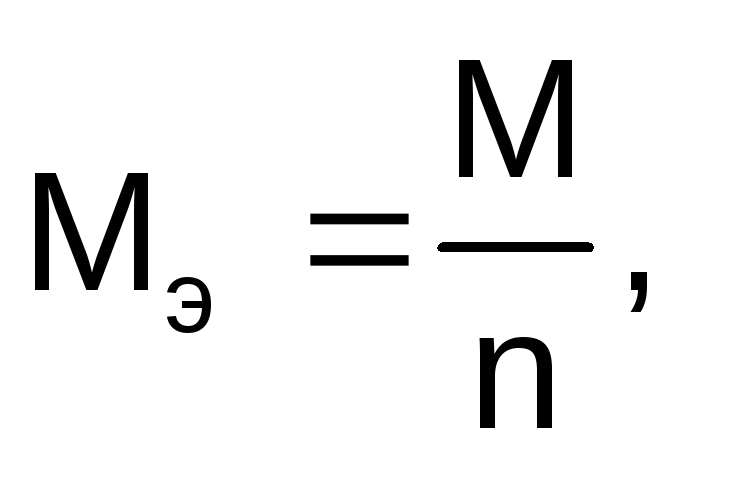
где М – молярная масса вещества, г/моль;
n – число электронов, участвующих в электродном процессе.
Для расчета объемов газообразных продуктов электролиза в законе Фарадея молярная масса эквивалентов вещества Мэ заменяется на молярный объем эквивалента газа при нормальных условиях (Vэ), который рассчитывается по формуле:
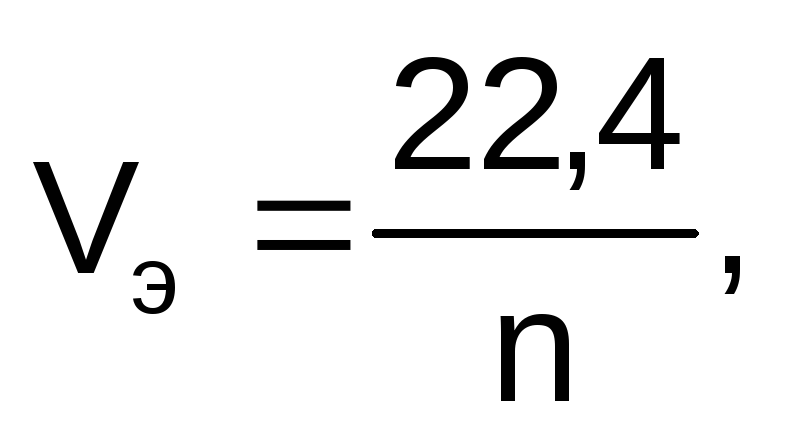
где 22,4 – это объем,
который занимает 1 моль любого газа при
нормальных условиях, л; n
– число 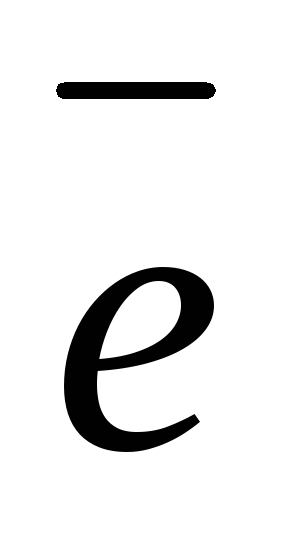 ,
отданных или принятых 1 моль газа.
,
отданных или принятых 1 моль газа.
При проведении электролиза в реальных условиях, вследствие побочных процессов масса вещества, выделившегося на электроде, оказывается меньше массы, рассчитанной по закону Фарадея. Отношение массы вещества, полученной при электролизе (mпракт.) к массе вещества, рассчитанной по закону Фарадея (mтеор.), выраженное в процентах, называется выходом по току (Вт):
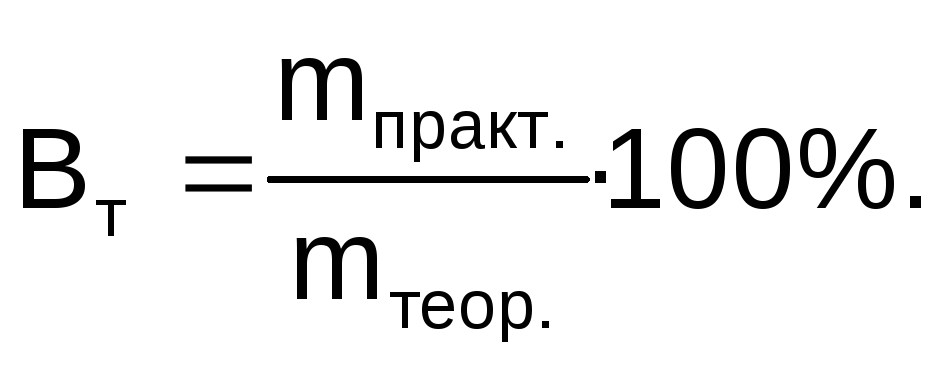
Пример 1. Составьте электронные уравнения электродных процессов, протекающих при электролизе раствора CuSO4. Определите массу меди и объем газа, выделившихся на электродах при прохождении тока силой 5 А в течение 2 часов.
Решение. В водном растворе CuSO4 диссоциирует по схеме
CuSO4 Cu2+ + SO42–
При электролизе раствора соли CuSO4 на катоде будут восстанавливаться ионы Cu2+, а на аноде – окисляться молекулы воды.
К атод
(–):Cu2+ + 2
атод
(–):Cu2+ + 2
Cu
2
Cu
2
Анод (+): 2Н2О
— 4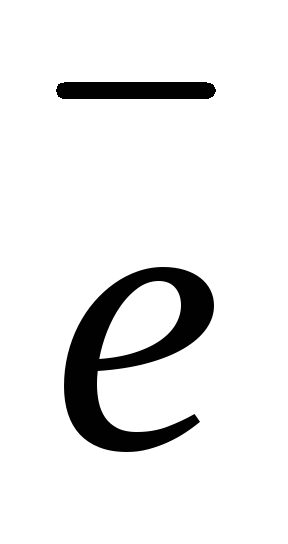
О2 + 4Н+ 1
О2 + 4Н+ 1

Суммарная реакция: 2CuSO4 + 2H2O 2Cu + O2 + 2H2SO4
Молекулы H2SO4 образуются в результате побочной реакции между ионами Н+ и кислотными остатками SO42–, которые накапливаются у поверхности анода.
Масса меди, выделившейся на катоде:
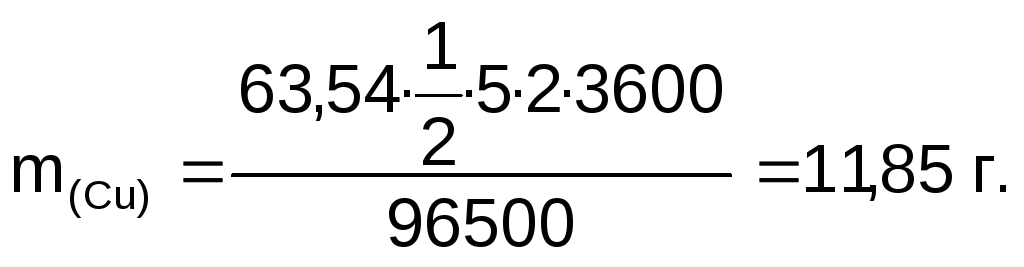
Объем кислорода, выделившегося на аноде:

Ответ: m(Сг)=11,85
г; 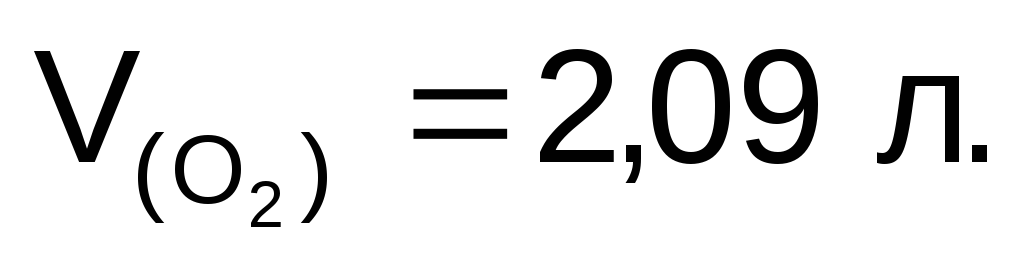
Пример 2. Составьте схему электролиза водного раствора соли NaCl и рассчитайте массу образовавшегося на катоде гидроксида натрия, если на аноде выделилось 1,12 л газа.
Решение. В водном растворе NaCl диссоциирует по схеме:
NaCl Na+ + Cl–
При электролизе раствора NaCl на катоде будет восстанавливаться водород из молекул воды, а на аноде – окисляться ионы Cl– до газообразного Cl2:
К атод
(–): 2Н2О
+ 2
атод
(–): 2Н2О
+ 2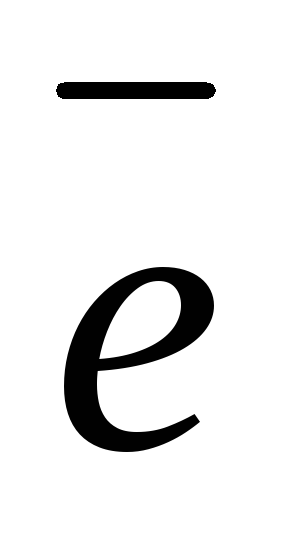
Н2 + 2ОН– 1
Н2 + 2ОН– 1
Анод (+): 2Cl– — 2
Cl2 1
Cl2 1

Суммарная реакция: 2NaCl + 2H2O H2 + 2NaOH + Cl2
Молекулы NaОН образуются в результате взаимодействия ионов ОН– с ионами Na+, которые накапливаются у поверхности катода.
Молярный объем эквивалента хлора:
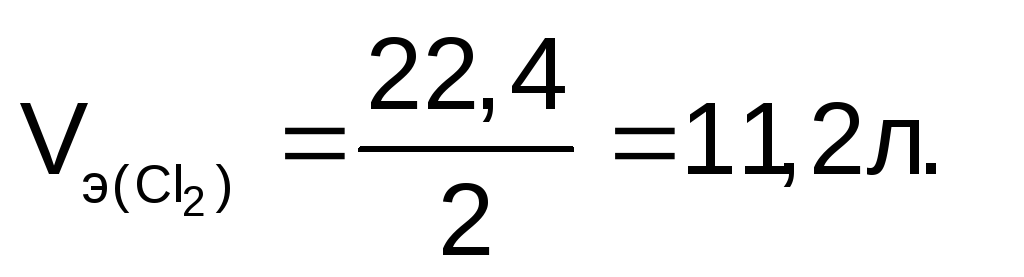
Количество эквивалентов хлора:
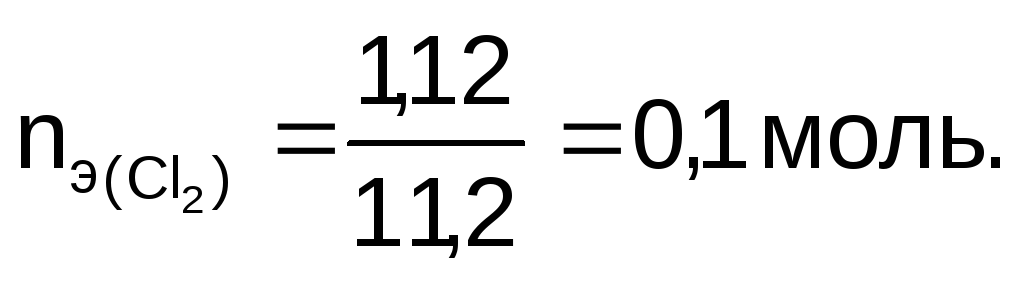
Так как на электродах выделяется одинаковое количество эквивалентов веществ, то
nэ(NaOH) = 0,1 моль.
Масса образовавшегося NaOH:
n(NaOH) = Mэ(NaOH)nэ(NaOH) = 40 0,1 = 4 г.
Ответ: 4 г.
Пример 3. Определите массу цинка, который выделится на катоде при электролизе сульфата цинка в течение 1 часа при токе 26,8 А, если выход цинка по току равен 58%. Составьте схему электродных процессов.
Решение. Согласно закону Фарадея масса выделившегося цинка:
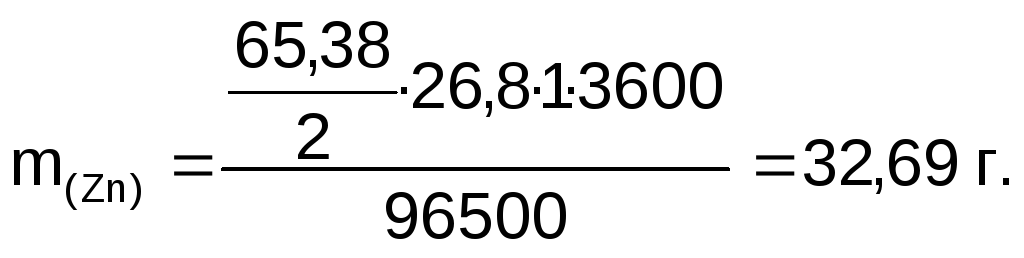
С учетом выхода по току практически выделившаяся масса цинка:

С хема
электролиза раствораZnSO4:
хема
электролиза раствораZnSO4:
ZnSO4 Zn2+ + SO42–
К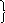
1
атод (–):Zn2+ + 2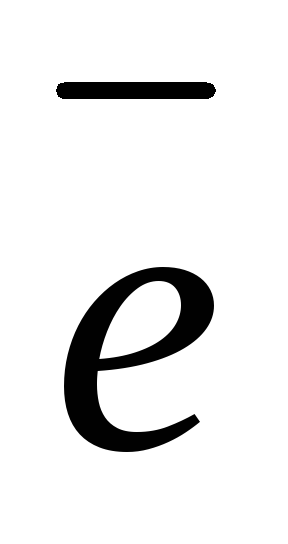
Zn
Zn 2H2O
+ 2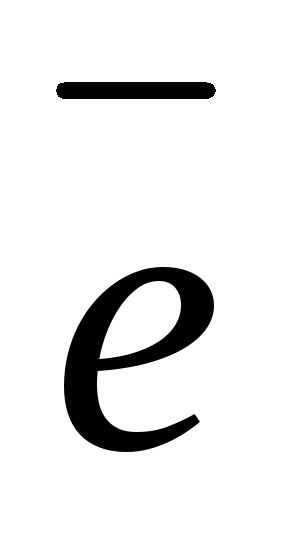
H2 + 2OH–
H2 + 2OH–
А нод
(+): 2H2O
— 4
нод
(+): 2H2O
— 4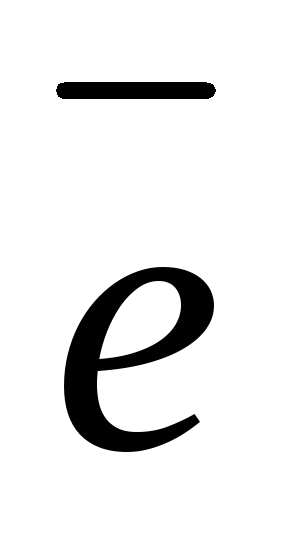
O2 + 4H+ 1
O2 + 4H+ 1
Cуммарная реакция:
2ZnSO4 + 4H2O Zn + H2 + Zn(OH)2 + O2 + 2H2SO4
Низкий выход по току цинка объясняется тем, что одновременно с цинком на катоде восстанавливаются молекулы воды и часть электричества расходуется на этот процесс.
Ответ: 18,96 г.
studfile.net
1.14.2. Законы электролиза Фарадея
а). Первый закон электролиза
Масса вещества (m), выделившаяся на электроде, прямо пропорциональна электрическом заряду (q), прошедшему через электролит.
m = kq или m = kIt, (1.52)
(поскольку q = It, где I — сила тока, протекающего через раствор электролита за время t, где k — электрохимический эквивалент вещества.
Электрохимический эквивалент вещества численно равен массе вещества, которая осаждается на электроде при прохождении тока через электролит единицы количества электричества (единичный заряд).
б). Второй закон электролиза
Электрохимический эквивалент вещества прямо пропорционален отношению молярной массы к валентности n.
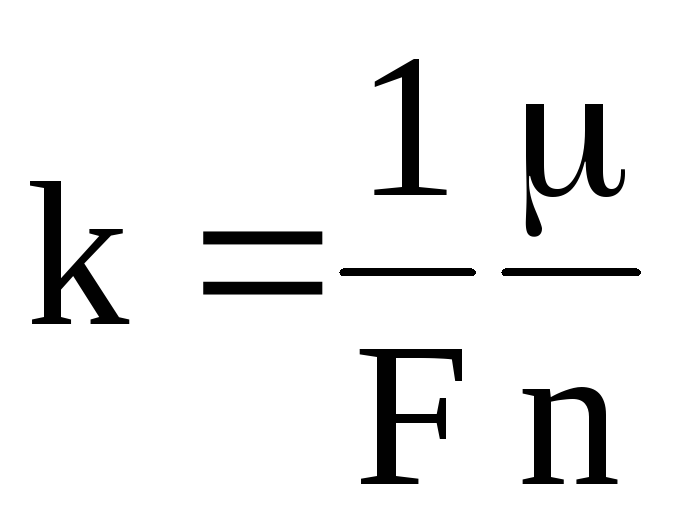 ,
(1.53)
,
(1.53)
где F = 9,648104 Кл/моль — число Фарадея.
в). Объединенный закон электролиза Фарадея
Первый и второй законы электролиза можно объединить. Тогда получаем
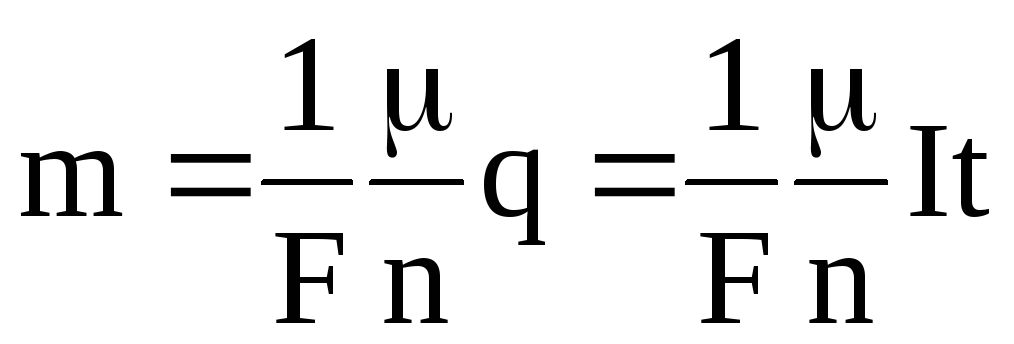 (1.54)
(1.54)
Из объединенного закона электролиза Фарадея следует, что число Фарадея численно равно электрическому заряду, прошедшему через электролит при выделении на электроде массы (кг) вещества, равной отношению /n.
1.15. Понятие о плазме
Подавляющая часть вещества нашей Вселенной находится в состоянии плазмы.
Плазмой называют ионизированный газ с высокой концентрацией заряженных частиц, обладающих свойством квазинейтральности.
Квазинейтральность плазмы заключается в том, что в достаточно большом объеме плазмы количество положительных и отрицательных зарядов практически одинаково. Отношение числа ионизированных атомов к их полному числу в том же объеме называют степенью ионизации плазмы . Если степень ионизации 103, то вещество относят к плазме. В плазменном состоянии находится вещество галактик, звезд, межзвездной среды и т. п., в которых сосредоточена почти вся масса наблюдаемой Вселенной. В звездах молекулы ионизируются в результате тепловых столкновений. Температура внутри нашего Солнца — типичной звезды — составляет 1,5107 К, что соответствует кинетической энергии kT = 2,721016 Дж и намного превышает энергию, необходимую для ионизации любой молекулы (атома), поскольку энергия ионизации молекулы 10191018 Дж. Межзвездный газ превращается в плазму из-за сильной разреженности; его плотность 10201026 кг/м3. Плазма существует и в непосредственной близости от земной поверхности. Так, ионосфера — внешний слой земной атмосферы состоит из сильно ионизированного газа. За ионосферой расположена магнитосфера, в которой находятся радиационные пояса Земли, внутренний и внешний, заполненные заряженными частицами, в основном электронами и протонами различных энергий. Основное качественное отличие слабо ионизированного газа от плазмы проявляется в поведении местных нарушений нейтральности среды, возникает за счет тепловых флуктуаций. В газе такие нарушения, после возникновения, развиваются беспорядочно и могут заполнить весь объем. В плазме же флуктуационные нарушения нейтральности всегда жестко локализованы в достаточно малом объеме. Так как масса ионов значительно больше массы электронов, то более подвижными в плазме являются электроны. Допустим, что область нарушения электронейтральности образуется в некотором слое небольшой толщины х (рис. 1.10, а).
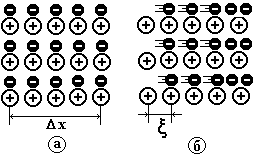
Рис. 1.10
При его смещении, например, вправо относительно такого же слоя ионов на расстояние х (рис. 1.10 б), слой (типа плоского конденсатора) с поверхностной плотностью заряда = qen, где qe — заряд электрона; n — концентрация электронов. Возникает двойной заряженный слой. Между обкладками такого “плазменного” конденсатора возникает электрическое поле напряженности 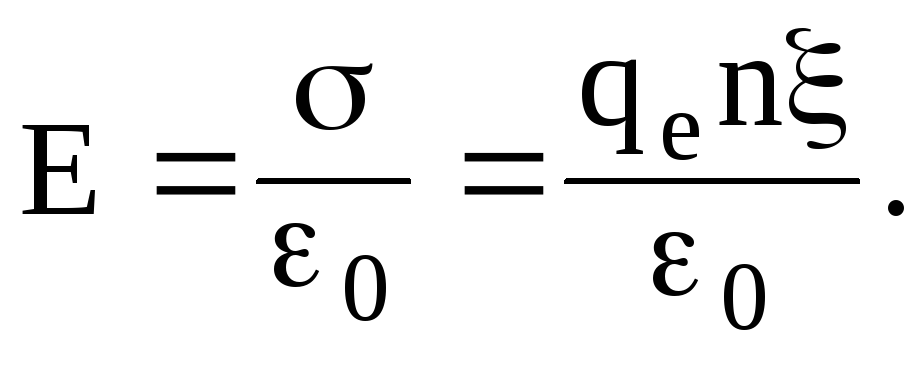 (1.55)
(1.55)
Если площадь обкладок S, тогда внутри конденсатора находится nxS электронов. На них будет действовать кулоновская сила
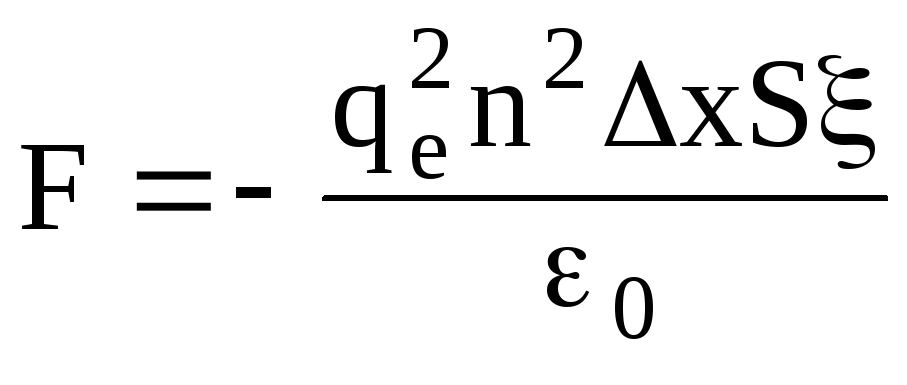 .
(1.56)
.
(1.56)
Масса всех электронов m = menxS, а ускорение их движения
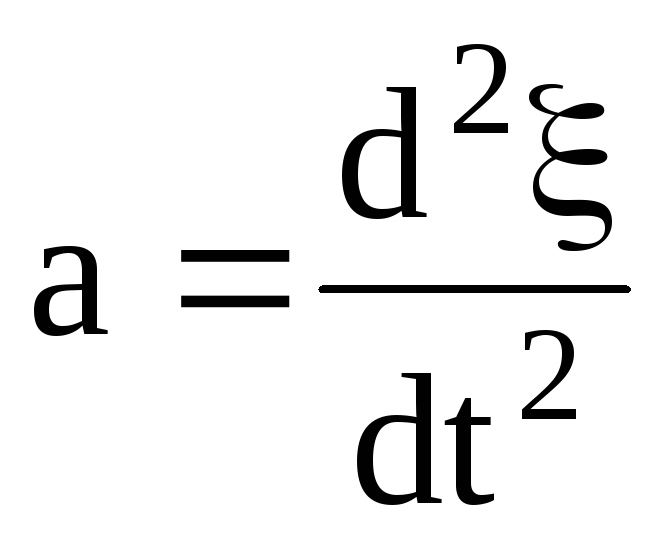 .
.
Согласно второму
закону Ньютона 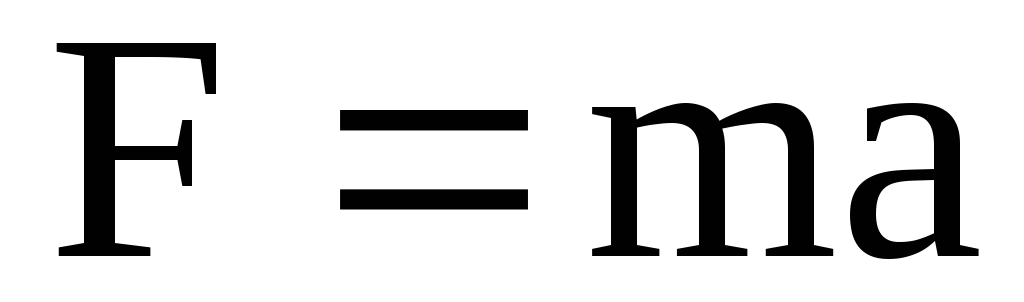
или 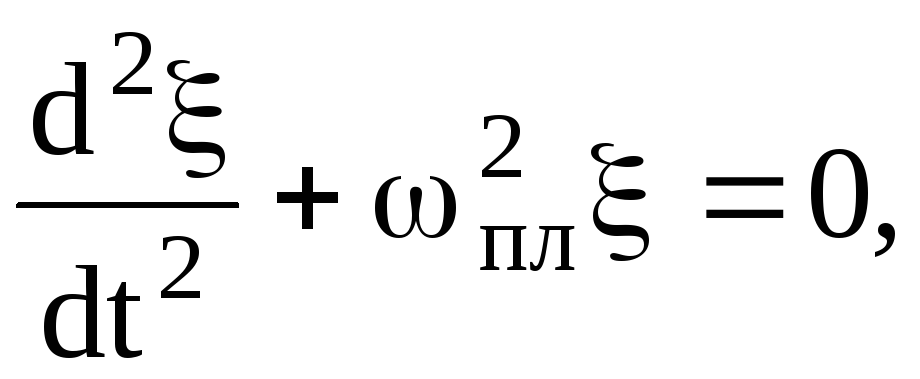 (1.57)
(1.57)
где
menxS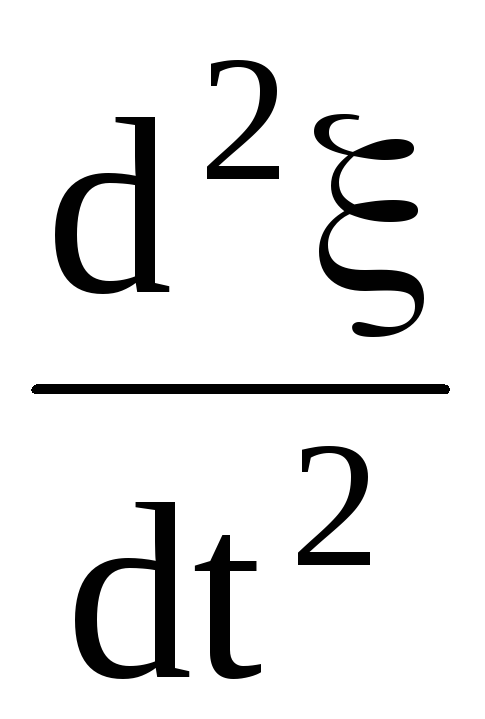 =
=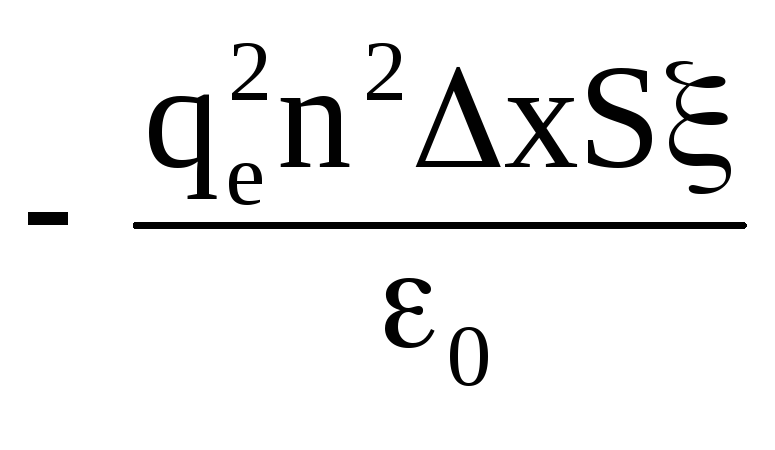 ,
(1.58)
,
(1.58)
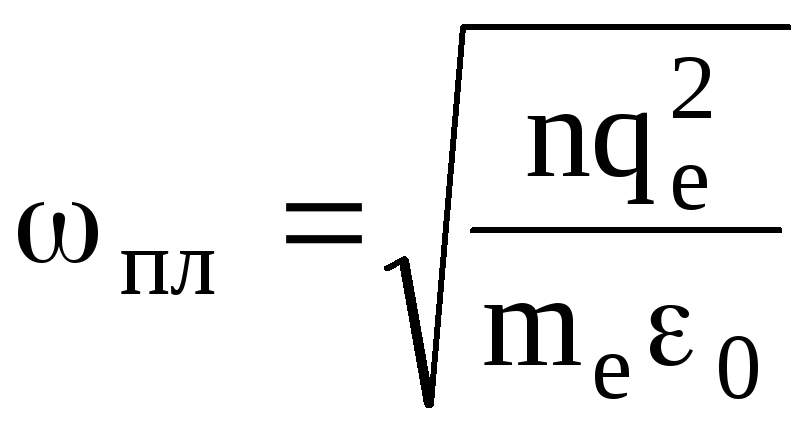 .
(1.59)
.
(1.59)
Колебания, описываемые формулой (1.59 ), называют плазменными. пл — плазменная частота.
Вывод: При нарушении электронейтральности в какой-либо области плазмы в ней возникают гармонические колебания плотности заряда с частотой пл. Но плазменные колебания не имеют волнового характера, т. е. нарушение электронейтральности не распространяется по плазме.
Характерное время существования нарушения электронейтральности плазмы в лабораторных условиях 1013с tпл 103с. Учет столкновений ионов и электронов (друг с другом и с нейтральными молекулами) приводит к затуханию плазменных колебаний. Характерный размер областей, в которых можно наблюдать флуктуационные нарушения электронейтральности, определяется дебаевским радиусом (размером)
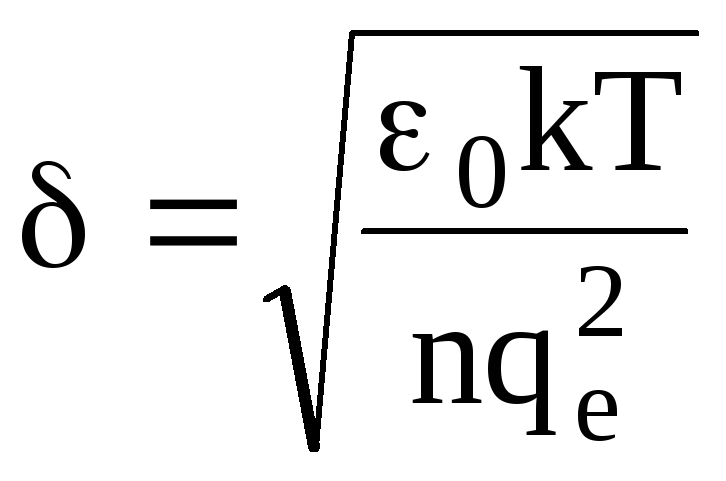 ,
(1.60)
,
(1.60)
который можно найти из условия равенства энергии плазменных колебаний одного электрона и тепловой энергии, приходящейся на одну степень свободы электрона, т. е. kT. Дебаевский размер для наиболее распространенных видов плазмы на несколько порядков превосходит размер атомов или молекул.
Следовательно, в плазме несущественны квантовые эффекты и ее поведение описывается законами классической физики.
Если в плазму ввести пробный, например, положительный заряд +q0, то расположенные по соседству электроны будут им притягиваться, а положительные ионы, наоборот, отталкиваться. В результате вокруг положительного заряда возникает сферически симметричное отрицательно заряженное облако. Оно будет экранировать действие заряда q0 на расположенную вокруг плазму, которая возникает в результате суперпозиции поля положительного заряда q0 и поля, отрицательно заряженного окружающего его облака. Поэтому на некотором удалении от заряда q0 поле, образованное такой суперпозицией, будет исчезающе мало. Это расстояние и определяется дебаевским радиусом экранирования. Плазму экранируюет также и внешнее электрическое поле на расстоянии порядка дебаевского размера.
Полученные результаты справедливы для плазмы, находящейся в состоянии термодинамического равновесия. На практике такое состояние не наблюдается. Поэтому средние кинетические энергии для электронов и ионов оказываются различными, т. е. температура электронов Те и температура ионов Тi не равны, причем Те>Тi. Для равновесной плазмы Те = Тi. При значении ионной температуры Тi<105 K плазму называют низкотемпературной, а при Тi>106 K — высокотемпературной. В плазме взаимодействует большое число частиц. Этим она резко отличается от газов. Средняя потенциальная энергия взаимодействия частиц плазмы мала по сравнению с их кинетической энергией. Поэтому тепловое движение частиц в плазме и идеальном газе имеет большое сходство. Термодинамические свойства плазмы с хорошей степенью точности описываются уравнением состояния идеального газа. Таким образом, плазма представляет собой идеальный газ, состоящий из двух противоположно заряженных частиц — ионов и электронов. Плазменные колебания — упорядоченное движение зарядов подобно звуку в веществе. Это движение дополняет тепловое движение, участвуя в котором каждая заряженная частица плазмы перемещается по плавно извивающейся линии, так как импульс каждой из них меняется в зависимости от времени очень медленно. Наличие в плазме заряженных частиц объясняет ее хорошую электропроводность. Время релаксации плазменных электронов , определяется как среднее время, за которое движение электрона теряет свою упорядоченность, т. е.
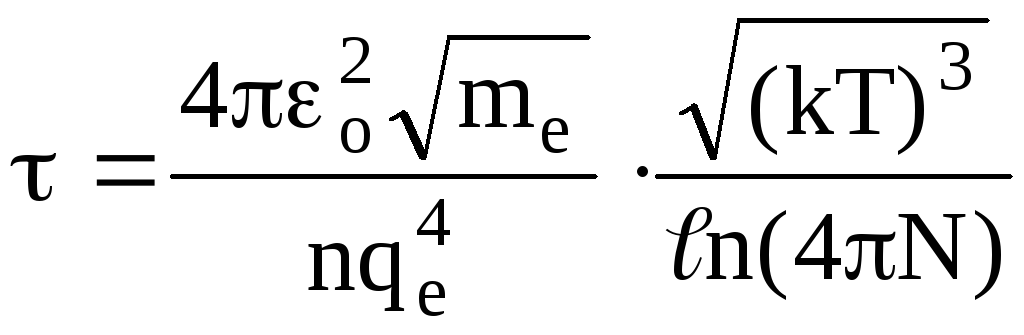 .
(1.61)
.
(1.61)
Поэтому удельная электропроводность плазмы
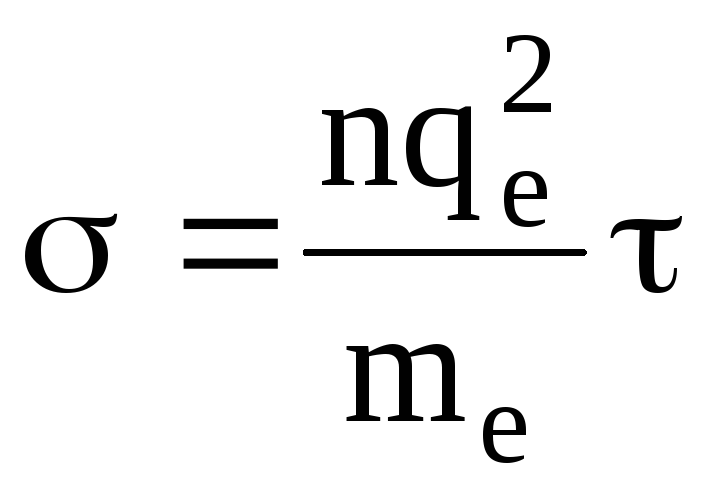 (1.62)
(1.62)
или
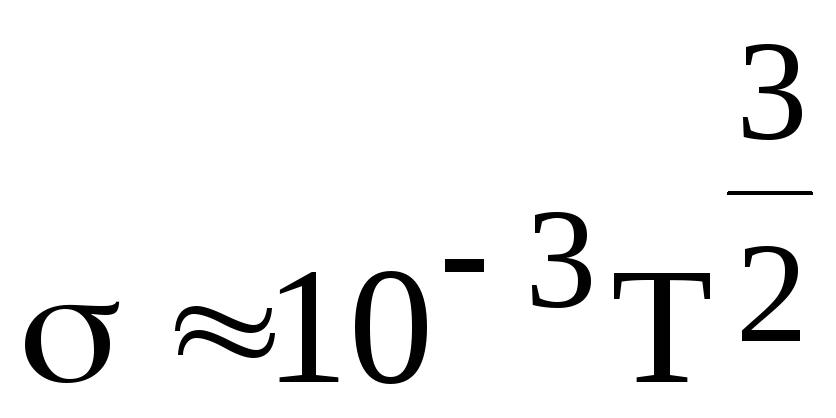 1/(Омм).
(1.63)
1/(Омм).
(1.63)
Удельная электропроводность плазмы слабо зависит от концентрации носителей, так как в ней столкновения носителей практически не играют роли. Температурная зависимость удельной электропроводности плазмы растет пропорционально Т3/2.
Следовательно, достаточно разогретая плазма является хорошим проводником.
Например, при температурах Т 108 К, достигаемых в установках для термоядерных реакций, удельная электропроводность плазмы имеет значения порядка 109 1/(Омм), что на порядок превышает проводимость лучших металлических проводников.
При внесении плазмы в магнитное поле электроны и ионы начинают двигаться по винтовой линии, закручивающейся вокруг силовых линий магнитного поля с частотой для электрона
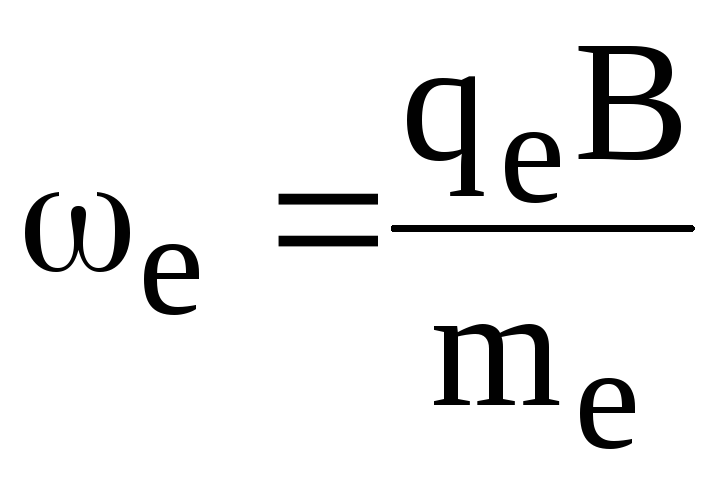 (1.64)
(1.64)
и для иона
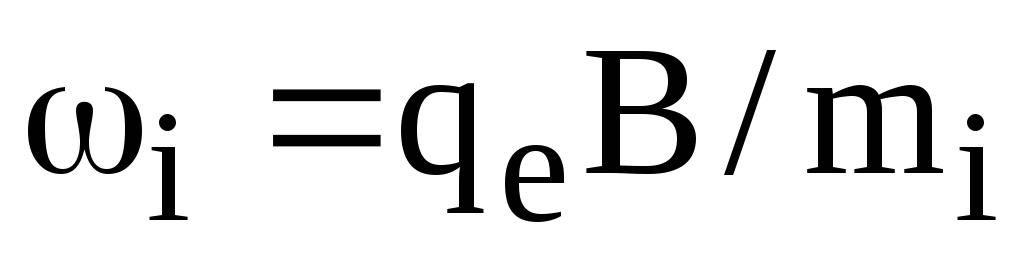 ,
(1.65)
,
(1.65)
где В — индукция магнитного поля.
Способность магнитного поля удерживать плазму от растекания используется в установках для осуществления термоядерного синтеза в высокотемпературной водородной плазме при Т 108 К.
studfile.net
Электролиз. Законы фарадея
Окислительно-восстановительный процесс, принудительно протекающий под действием электрического тока, называется электролизом.
Электролиз проводят в электролизере, заполненном электролитом, в который погружены электроды, подсоединенные к внешнему источнику тока.
Электрод, подсоединенный к отрицательному полюсу внешнего источника тока, называется катодом. На катоде протекают процессы восстановления частиц электролита. Электрод, подсоединенный к положительному полюсу источника тока, называется анодом. На аноде протекают процессы окисления частиц электролита или материала электрода.
Анодные процессы зависят от природы электролита и материала анода. В связи с этим различают электролиз с инертным и растворимым анодом.
Инертным называется анод, материал которого не окисляется в ходе электролиза. К инертным электродам относятся, например, графитовый (угольный) и платиновый.
Растворимым называется анод, материал которого может окисляться в ходе электролиза. Большинство металлических электродов являются растворимыми.
В качестве электролита могут быть использованы растворы или расплавы. В растворе или расплаве электролита ионы находятся в хаотичном движении. Под действием электрического тока ионы приобретают направленное движение: катионы движутся к катоду, а анионы — к аноду и, соответственно, на электродах они могут разряжаться.
При электролизе расплавов с инертными электродами на катоде возможно восстановление только катионов металла, а на аноде − окисление анионов.
При электролизе водных растворов на катоде кроме катионов металла, могут восстанавливаться молекулы воды, а в кислых растворах — ионы водорода Н+. Таким образом, на катоде возможны следующие конкурирующие реакции:
(-) К: Меn+ + nē → Me
2H2O + 2 ē → H2 + 2 OH—
2Н+ + 2 ē → Н2
26
На катоде в первую очередь протекает реакция с наибольшим значением электродного потенциала.
При электролизе водных растворов с растворимым анодом, кроме окисления анионов, возможны реакции окисления самого электрода, молекул воды и в щелочных растворах гидроксид-ионов (ОН—):
(+) А: Me — n ē → Меn+
окисление аниона Е0
2H2O – 4 ē O2 + 4 H+
4OH–— 4 ē = O2 +2H2O
На аноде в первую очередь протекает реакция с наименьшим значением электродного потенциала.
Для электродных реакций приведены равновесные потенциалы в отсутствии электрического тока.
Электролиз — процесс неравновесный, поэтому потенциалы электродных реакций под током отличаются от своих равновесных значений. Смещение потенциала электрода от его равновесного значения под влиянием внешнего тока называется электродной поляризацией. Величина поляризации называется перенапряжением. На величину перенапряжения влияют многие факторы: природа материала электрода, плотность тока, температура, рН-среды и др.
Перенапряжения катодного выделения металлов сравнительно невелики.
С высоким перенапряжением, как правило, протекает процесс образования газов, таких как водород и кислород. Минимальное перенапряжение водорода на катоде в кислых растворах наблюдается на Pt (=0,1 В), а максимальное −на свинце, цинке, кадмии и ртути. Перенапряжение изменяется при замене кислых растворов на щелочные. Например, на платине в щелочной среде перенапряжение водорода =0,31 В (см. приложение).
Анодное выделение кислорода также связано с перенапряжением. Минимальное перенапряжение выделения кислорода наблюдается на Pt-электродах (=0,7 В), а максимальное − на цинке, ртути и свинце (см. приложение).
27
Из вышеизложенного следует, что при электролизе водных растворов:
1) на катоде восстанавливаются ионы металлов, электродные потенциалы которых больше потенциала восстановления воды (-0,82В). Ионы металлов, имеющие более отрицательные электродные потенциалы чем -0,82В, не восстанавливаются. К ним относятся ионы щелочных и щелочноземельных металлов и алюминия.
2) на инертном аноде с учетом перенапряжения кислорода протекает окисление тех анионов, потенциал которых меньше потенциала окисления воды (+1,23В). К таким анионам относятся, например, I—, Br—, Cl—, NO2—, ОН—. Анионы СO32-, РO43-, NO3—, F— — не окисляемы.
3) при электролизе с растворимым анодом, в нейтральных и кислых средах растворяются электроды из тех металлов, электродный потенциал которых меньше +1,23В, а в щелочных – меньше, чем +0,413В.
Суммарными продуктами процессов на катоде и аноде являются электронейтральные вещества.
Для осуществления процесса электролиза на электроды необходимо подать напряжение. Напряжение электролиза Uэл-за – это разность потенциалов, необходимая для протекания реакций на катоде и аноде. Теоретическое напряжение электролиза (Uэл-за, теор) без учета перенапряжения, омического падения напряжения в проводниках первого рода и в электролите
Uэл-за, теор = Eа – Eк , (7)
где Eа , Eк — потенциалы анодных и катодных реакций.
Связь между количеством выделившегося при электролизе вещества и количеством прошедшего через электролит тока выражается двумя законами Фарадея.
I закон Фарадея. Количество вещества, образовавшегося на электроде при электролизе, прямо пропорционально количеству электричества, прошедшему через раствор (расплав) электролита:
, (8)
28
где k – электрохимический эквивалент, г/Кл или г/А·ч; Q – количество электричества, Кулон, Q =It; t-время, с; I-ток, А; F = 96500 Кл/моль (А·с/моль) = 26,8 А·ч/моль – постоянная Фарадея; Э- эквивалентная масса вещества, г/моль.
В электрохимических реакциях эквивалентная масса вещества определяется:
. (9)
n –число электронов, участвующих в электродной реакции образования этого вещества.
II закон Фарадея. При прохождении через разные электролиты одного и того же количества электричества массы веществ, выделившихся на электродах, пропорциональны их эквивалентным массам:
, (10)
где m1 и m2 – массы веществ 1 и 2, Э1 и Э2, г/моль – эквивалентные массы веществ 1 и 2.
На практике часто вследствие протекания конкурирующих окислительно-восстановительных процессов на электродах образуется меньше вещества, чем соответствует прошедшему через раствор электричеству.
Для характеристики потерь электричества при электролизе введено понятие «Выход по току». Выходом по току Вт называется выраженное в процентах отношение количества фактически полученного продукта электролиза mфакт. к теоретически рассчитанному mтеор:
Пример 10. Какие процессы будут протекать при электролизе водного раствора сульфата натрия с угольным анодом? Какие вещества будут выделяться на электродах, если угольный электрод заменить на медный?
Решение: В растворе сульфата натрия в электродных процессах могут участвовать ионы натрия Na+, SO42- и молекулы воды. Угольные электроды относятся к инертным электродам.
На катоде возможны следующие процессы восстановления:
29
(-) К: Na+ + ē → Na
2H2O + 2 ē → H2 + 2 OH—
На катоде в первую очередь протекает реакция с наибольшим значением электродного потенциала. Поэтому на катоде будет происходить восстановление молекул воды, сопровождающееся выделением водорода и образованием в прикатодном пространстве гидроксид- ионов ОН—. Имеющиеся у катода ионы натрия Na+ совместно с ионами ОН— будут образовывать раствор щелочи NaOH.
На аноде возможны следующие реакции:
(+)А: 2 SO42- — 2 ē → S2O82-
2 H2O — 4 ē → 4H+ + O2.
На аноде в первую очередь протекает реакция с наименьшим значением электродного потенциала. Поэтому на аноде будет протекать окисление молекул воды с выделением кислорода, а в прианодном пространстве накапливаются ионы Н+. Имеющиеся у анода ионы SO42- с ионами Н+ будут образовывать раствор серной кислоты H2SO4.
Суммарная реакция электролиза выражается уравнением:
2 Na2SO4 + 6H2O = 2H2 + 4 NaOH + O2 + 2H2SO4.
катодные продукты анодные продукты
При замене угольного (инертного) анода на медный на аноде становится возможным протекание еще одной реакции окисления – растворение меди:
Cu – 2 ē → Cu2+
Этот процесс характеризуется меньшим значением потенциала, чем остальные возможные анодные процессы. Поэтому при электролизе Na2SO4 с медным анодом на аноде пройдет окисление меди, а в анодном пространстве будет накапливаться сульфат меди CuSO4. Cуммарная реакция электролиза выразится уравнением:
Na2SO4 + 2H2O + Cu = H2 + 2 NaOH + CuSO4.
катодные продукты анодный продукт
Пример 11. Составьте уравнение процессов, протекающих при электролизе водного раствора хлорида никеля NiCl2 с инертным анодом.
30
Решение: В растворе хлорида никеля в электродных процессах могут участвовать ионы никеля Ni2+, Cl— и молекулы воды. В качестве инертного анода можно использовать графитовый электрод.
На катоде возможны следующие реакции:
(-) К: Ni2+ + 2 ē → Ni
2H2O + 2 ē → H2 + 2 OH—
Потенциал первой реакции выше, поэтому на катоде протекает восстановление ионов никеля.
На аноде возможны следующие реакции:
(+) А: 2 Cl— — 2 ē → Cl2
2H2O – 4 ē O2 + 4 H+.
Согласно величинам стандартных электродных потенциалов на аноде
должен выделяться кислород. В действительности, из-за высокого перенапряжения кислорода на электроде выделяется хлор. Величина перенапряжения зависит от материала, из которого изготовлен электрод. Для графита перенапряжение кислорода составляет 1,17 В при плотности тока равной 1а/см2, что повышает потенциал окисления воды до 2,4 В.
Следовательно, электролиз раствора хлорида никеля протекает с образованием никеля и хлора:
Ni2+ + 2Cl— = Ni + Cl2.
на катоде на аноде
Пример 12. Вычислить массу вещества и объем газа, выделившихся на инертных электродах при электролизе водного раствора нитрата серебра AgNO3, если время электролиза составляет 25 мин, а сила тока 3 А.
Решение. При электролизе водного раствора AgNO3 в случае с нерастворимым анодом (например, графитовый) на электродах протекают процессы:
(-) К: Ag+ + ē → Ag ,
2H2O + 2 ē → H2 + 2OH— .
Потенциал первой реакции выше, поэтому на катоде протекает восстановление ионов серебра.
(+) A: 2H2O – 4 ē O2 + 4 H+,
анион NO3— не окисляем.
31
Анодные и катодные процессы связаны между собой: восстановление на катоде идет в той мере, в какой идет окисление на аноде. Другими словами, число электронов в анодной и катодной реакции должно быть одинаково, следовательно, катодную реакцию необходимо домножить на 4.
Суммарное уравнение электролиза нитрата серебра AgNO3:
4 AgNO3 + 2H2O = 4Ag + O2 + 4HNO3
на катоде анодные продукты
На катоде выделяется серебро. Эквивалентная масса cеребра г/моль. Массу серебра рассчитываем по первому закону Фарадея:. На аноде образуется кислород. Эквивалентная масса кислородаг/моль. Массу кислорода рассчитываем по второму закону Фарадея:, откудаг или в литрахл.
studfile.net
1.4. Законы Фарадея (законы электролиза)
Связь между количеством выделившегося при электролизе веществ и количеством электричества, прошедшего через электролит, выражается двумя законами Фарадея.
Первый закон Фарадея. Масса вещества, выделившегося на электроде при электролизе, прямо пропорциональна количеству электричества, прошедшего через электролит:
m = kQ,
где m — масса вещества, г; k – электрохимический эквивалент, т.е. масса вещества, выделившаяся при прохождении одного кулона электричества, г/Кл; Q – количество электричества, Кл (Q = It, где I — сила тока, t — время, с).
Второй закон Фарадея. Одинаковое количество электричества выделяет при электролизе на электродах эквивалентные массы различных веществ. Для выделения одного моля эквивалента любого вещества необходимо затратить одно и то же количество электричества, а именно 96485 Кл, называемое числом Фарадея.
Тогда электрохимический эквивалент:
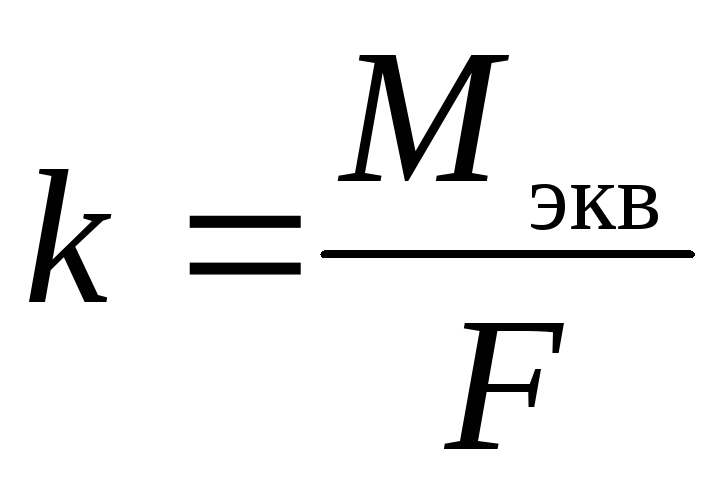 ,
,
где Mэкв — молярная масса химического эквивалента вещества (иона), г/моль экв.
Из первого и второго законов Фарадея вытекает объединенное уравнение:
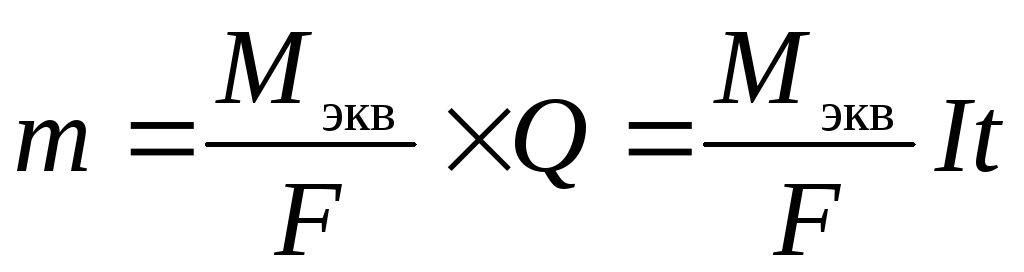 ;
;
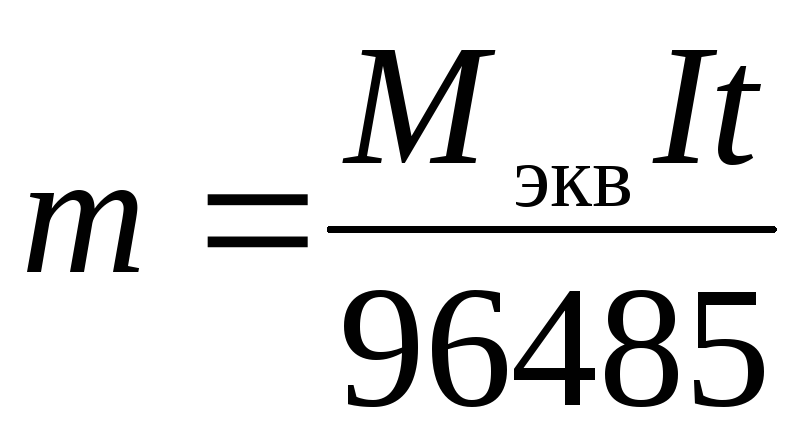 .
(4)
.
(4)
1.5. Примеры решения задач
Пример 1. Написать уравнения электрохимических процессов, происходящих на аноде (анод инертный) и катоде при электролизе раствора бромида меди (II).
Решение. В водном растворе CuBr2 диссоциирует следующим образом:
CuBr2←→ Cu2+ + 2Br –.
Стандартный электродный потенциал водородного электрода в нейтральной водной среде:
2H2O + 2ē → H2↑ + 2OH– (–0,41В).
Это значительно отрицательнее потенциала системы:
Cu2+ + 2e → Cu0 (+0,34В).
Поэтому на катоде будет происходить электрохимическое осаждение меди:
Cu2+ + 2ē → Cu0.
На аноде будет происходить окисление ионов брома, приводящее к выделению газообразного брома:
Br – – ē → Br0 ;
2Br0 → Br2↑;
поскольку электрохимическое окисление воды:
2H2O – 4e → O2↑ + 4H+
из нейтральных сред может протекать при потенциалах не менее (+1,23 В), что выше стандартного электродного потенциала, характеризующего выделение газообразного брома (+1,07 В).
Пример 2. Написать уравнения электрохимических процессов, происходящих на аноде и катоде при электролизе раствора сульфата натрия (анод инертный).
Решение. В водном растворе Na2SO4 диссоциирует следующим образом:
Na2SO4←→ 2Na+ + SO42–.
Стандартный электродный потенциал системы:
Na+ + ē → Na0 (–2,71 В)
значительно отрицательнее потенциала водородного электрода в нейтральной среде (–0,41 В). Поэтому на катоде будет происходить электрохимическое разложение воды с выделением водорода:
2H2O + 2ē → H2↑ + 2OH–,
а ионы натрия, приходящие к катоду, будут накапливаться в прилегающей к нему части раствора (катодное пространство).
На аноде будет происходить электрохимическое окисление воды, приводящее к выделению кислорода:
2H2O – 4e → O2↑ + 4H+,
поскольку отвечающей этой системе стандартный электродный потенциал (+1,23 В) значительно ниже, чем стандартный электродный потенциал (+2,01 В), характеризующий систему:
2SO42– – 2ē → S2O82–.
Сульфат-ионы, движущиеся при электролизе к аноду, будут накапливаться в анодном пространстве.
Пример 3. Написать уравнения электрохимических процессов, происходящих на катоде и аноде при электролизе раствора сульфата цинка с цинковым анодом.
Решение. В водном растворе ZnSO4 диссоциирует следующим образом:
ZnSO4←→ Zn2+ + SO42–.
Стандартный электродный потенциал системы:
Zn2+ + 2ē → Zn0 (–0,76 В)
близок к потенциалу водородного электрода в нейтральной водной среде (– 0,41 В), поэтому на катоде будут совместно протекать два процесса восстановления:
Zn2+ + 2ē → Zn0;
2H2O + 2ē → H2↑ + 2OH–.
На аноде возможно протекание трех окислительных процессов: электрохимического окисления воды, приводящего к выделению кислорода (+1,23 В), окисления сульфат-ионов (+2,01 В) и окисления материала анода, т.е. цинка (–0,76 В). Сравнение электродных потенциалов систем позволяет сделать вывод об окислении анода и выделении ионов цинка в раствор:
Zn0 – 2ē → Zn2+.
Пример 4. Определить массу цинка, которая выделится на катоде при электролизе сульфата цинка в течение одного часа при токе 26,8 А, если выход по току цинка равен 50 %.
Решение. Расчет ведем согласно объединенному уравнению из законов Фарадея (4). Масса моля эквивалента (химический эквивалент вещества) цинка в ZnSO4 равна (65,38 / 2) = 32,69 г/моль экв. Не забыв выразить время в секундах, подставим в уравнение закона Фарадея все известные значения и определим массу цинка, которая должна выделиться (при условии, если весь ток будет израсходован на выделение цинка):
m = (32,69 ∙ 26,8 ∙ 3600) / 96485 = 32,69 г.
Так как выход по току цинка составляет 50%, то практически на катоде выделится цинка:
mпр = 32,69 ∙ (50/100) = 16,345 г.
Пример 5. Рассчитать ток при электролизе раствора в течение 1 ч 40 мин 25 с, если на катоде выделилось 1,4 л водорода, измеренного при нормальных условиях.
Решение. Из формулы (4) выразим силу тока:
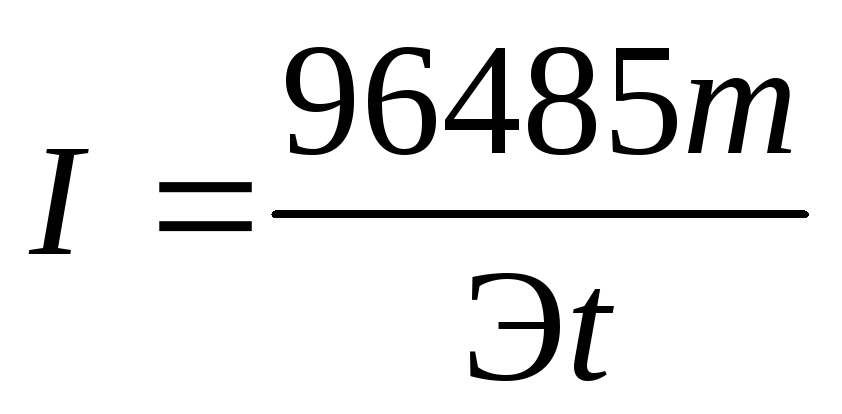 .
.
Так как количество водорода дано в единицах объема, то отношение m/Э заменяем отношением VH2/Vэкв H2 , где VH2 — объем водорода, л; Vэкв H2 — объем одного моля эквивалента водорода. Объем моля эквивалента водорода при нормальных условиях равен половине моля молекул водорода Vэкв H2 = 22,4/2 = 11,2 л, так как моль любого газа в нормальных условиях занимает объем, равный 22,4 л, а в процессе электрохимического восстановления водорода участвуют два электрона. Подставив в приведенную формулу числовые значения, получим:
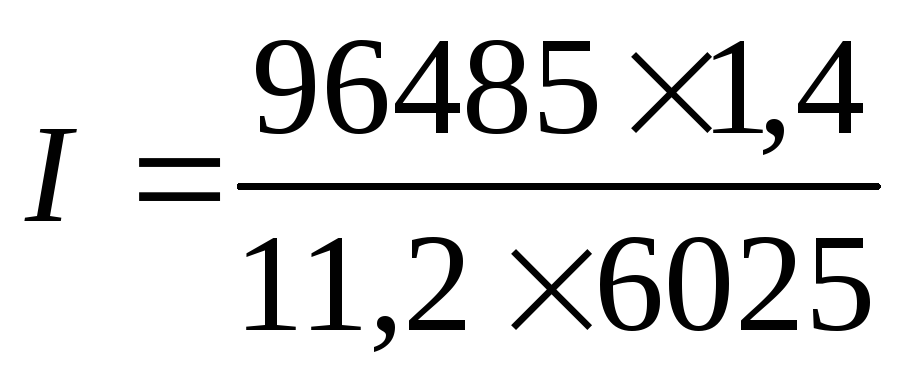 =
2 А.
=
2 А.
studfile.net
Законы электролиза Фарадея — это… Что такое Законы электролиза Фарадея?
 Майкл Фарадей, портрет Томаса Филипса, 1841-1842
Майкл Фарадей, портрет Томаса Филипса, 1841-1842Зако́ны электро́лиза Фараде́я являются количественными соотношениями, основанными на электрохимических исследованиях, опубликованных Майклом Фарадеем в 1836 году.[1]
Формулировка законов
В учебниках и научной литературе можно найти несколько версий формулировки законов. В наиболее общем виде законы формулируются следующим образом:
- Первый закон электролиза Фарадея: масса вещества, осаждённого на электроде при электролизе, прямо пропорциональна количеству электричества, переданного на этот электрод. Под количеством электричества имеется в виду электрический заряд, измеряемый, как правило, в кулонах.
- Второй закон электролиза Фарадея: для данного количества электричества (электрического заряда) масса химического элемента, осаждённого на электроде, прямо пропорциональна эквивалентной массе элемента. Эквивалентной массой вещества является его молярная масса, делённая на целое число, зависящее от химической реакции, в которой участвует вещество.
Математический вид
Законы Фарадея можно записать в виде следующей формулы:
где:
- m — масса осаждённого на электроде вещества в граммах
- Q — полный электрический заряд, прошедший через вещество
- F = 96 485,3383(83) Кл·моль−1 — постоянная Фарадея
- M — молярная масса вещества
- z — валентное число ионов вещества (число электронов на один ион).
Заметим, что M/z — это эквивалентная масса осаждённого вещества.
Для первого закона Фарадея M, F и z являются константами, так что чем больше величина Q, тем больше будет величина m.
Для второго закона Фарадея Q, F и z являются константами, так что чем больше величина M/z (эквивалентная масса), тем больше будет величина m.
В простейшем случае постоянного тока электролиза приводит к:
и тогда
где:
В более сложном случае переменного электрического тока полный заряд Q тока I() суммируется за время :
Здесь t — полное время электролиза. Обратите внимание, что тау используется в качестве переменной, ток I является функцией от тау.[2]
Примечания
- ↑ Ehl, Rosemary Gene; Ihde, Aaron (1954). «Faraday’s Electrochemical Laws and the Determination of Equivalent Weights». Journal of Chemical Education 31 (May): 226–232. DOI:10.1021/ed031p226. Bibcode: 1954JChEd..31..226E.
- ↑ For a similar treatment, see Strong, F. C. (1961). «Faraday’s Laws in One Equation». Journal of Chemical Education 38 (2): 98. DOI:10.1021/ed038p98.
Ссылки
- Serway, Moses, and Moyer, Modern Physics, third edition (2005).
См. также
dic.academic.ru
