Электролиз. Законы фарадея
Окислительно-восстановительный процесс, принудительно протекающий под действием электрического тока, называется электролизом.
Электролиз проводят в электролизере, заполненном электролитом, в который погружены электроды, подсоединенные к внешнему источнику тока.
Электрод, подсоединенный к отрицательному полюсу внешнего источника тока, называется катодом. На катоде протекают процессы восстановления частиц электролита. Электрод, подсоединенный к положительному полюсу источника тока, называется анодом. На аноде протекают процессы окисления частиц электролита или материала электрода.
Анодные процессы зависят от природы электролита и материала анода. В связи с этим различают электролиз с инертным и растворимым анодом.
Растворимым называется анод, материал которого может окисляться в ходе электролиза. Большинство металлических электродов являются растворимыми.
В качестве электролита могут быть использованы растворы или расплавы. В растворе или расплаве электролита ионы находятся в хаотичном движении. Под действием электрического тока ионы приобретают направленное движение: катионы движутся к катоду, а анионы — к аноду и, соответственно, на электродах они могут разряжаться.
При электролизе расплавов с инертными электродами на катоде возможно восстановление только катионов металла, а на аноде − окисление анионов.
При электролизе водных растворов на катоде кроме катионов металла, могут восстанавливаться молекулы воды, а в кислых растворах — ионы водорода Н +. Таким образом, на катоде возможны следующие конкурирующие реакции:
(-) К: Меn+ + nē → Me
2H2O + 2 ē → H2 + 2 OH—
2Н+ + 2 ē → Н2
26
На катоде в первую очередь протекает реакция с наибольшим значением электродного потенциала.
При электролизе водных растворов с растворимым анодом, кроме окисления анионов, возможны реакции окисления самого электрода, молекул воды и в щелочных растворах гидроксид-ионов (ОН—):
(+) А: Me — n ē → Меn+
окисление аниона
2H2O – 4 ē O2 + 4 H+
4OH–— 4 ē = O2 +2H2O
На аноде в первую очередь протекает реакция с наименьшим значением электродного потенциала.
Для электродных реакций приведены равновесные потенциалы в отсутствии электрического тока.
Электролиз — процесс неравновесный, поэтому потенциалы электродных реакций под током отличаются от своих равновесных значений. Смещение потенциала электрода от его равновесного значения под влиянием внешнего тока называется электродной поляризацией. Величина поляризации называется перенапряжением. На величину перенапряжения влияют многие факторы: природа материала электрода, плотность тока, температура, рН-среды и др.
Перенапряжения катодного выделения металлов сравнительно невелики.
С высоким перенапряжением, как правило, протекает процесс образования газов, таких как водород и кислород. Минимальное перенапряжение водорода на катоде в кислых растворах наблюдается на Pt (=0,1 В), а максимальное −на свинце, цинке, кадмии и ртути. Перенапряжение изменяется при замене кислых растворов на щелочные. Например, на платине в щелочной среде перенапряжение водорода =0,31 В (см. приложение).
Анодное выделение кислорода также связано с перенапряжением. Минимальное перенапряжение выделения кислорода наблюдается на Pt-электродах (=0,7 В), а максимальное − на цинке, ртути и свинце (см. приложение).
27
Из вышеизложенного следует, что при электролизе водных растворов:
1) на катоде восстанавливаются ионы металлов, электродные потенциалы которых больше потенциала восстановления воды (-0,82В). Ионы металлов, имеющие более отрицательные электродные потенциалы чем -0,82В, не восстанавливаются. К ним относятся ионы щелочных и щелочноземельных металлов и алюминия.
2) на инертном аноде с учетом перенапряжения кислорода протекает окисление тех анионов, потенциал которых меньше потенциала окисления воды (+1,23В). К таким анионам относятся, например, I—, Br—, Cl—, NO2—, ОН—. Анионы СO32-, РO43-, NO3—, F— — не окисляемы.
3) при электролизе с растворимым анодом, в нейтральных и кислых средах растворяются электроды из тех металлов, электродный потенциал которых меньше +1,23В, а в щелочных – меньше, чем +0,413В.
Суммарными продуктами процессов на катоде и аноде являются электронейтральные вещества.
Для осуществления процесса электролиза на электроды необходимо подать напряжение. Напряжение электролиза U
эл-за – это разность потенциалов, необходимая для протекания реакций на катоде и аноде. Теоретическое напряжение электролиза (Uэл-за, теор) без учета перенапряжения, омического падения напряжения в проводниках первого рода и в электролитеUэл-за, теор = Eа – Eк , (7)
где Eа , Eк — потенциалы анодных и катодных реакций.
Связь между количеством выделившегося при электролизе вещества и количеством прошедшего через электролит тока выражается двумя законами Фарадея.
I закон Фарадея. Количество вещества, образовавшегося на электроде при электролизе, прямо пропорционально количеству электричества, прошедшему через раствор (расплав) электролита:
, (8)
28
где k – электрохимический эквивалент, г/Кл или г/А·ч; Q – количество электричества, Кулон, Q =It; t-время, с; I-ток, А; F = 96500 Кл/моль (А·с/моль) = 26,8 А·ч/моль – постоянная Фарадея; Э- эквивалентная масса вещества, г/моль.
В электрохимических реакциях эквивалентная масса вещества определяется:
. (9)
n –число электронов, участвующих в электродной реакции образования этого вещества.
II закон Фарадея. При прохождении через разные электролиты одного и того же количества электричества массы веществ, выделившихся на электродах, пропорциональны их эквивалентным массам:
, (10)
где m1 и m2 – массы веществ 1 и 2, Э1 и Э2, г/моль – эквивалентные массы веществ 1 и 2.
На практике часто вследствие протекания конкурирующих окислительно-восстановительных процессов на электродах образуется меньше вещества, чем соответствует прошедшему через раствор электричеству.
Для характеристики потерь электричества при электролизе введено понятие «Выход по току». Выходом по току Вт называется выраженное в процентах отношение количества фактически полученного продукта электролиза mфакт. к теоретически рассчитанному mтеор:
Пример 10. Какие процессы будут протекать при электролизе водного раствора сульфата натрия с угольным анодом? Какие вещества будут выделяться на электродах, если угольный электрод заменить на медный?
Решение: В растворе сульфата натрия в электродных процессах могут участвовать ионы натрия Na+, SO42- и молекулы воды. Угольные электроды относятся к инертным электродам.
На катоде возможны следующие процессы восстановления:
29
(-) К: Na+ + ē → Na
2H2O + 2 ē → H2 + 2 OH—
На катоде в первую очередь протекает реакция с наибольшим значением электродного потенциала. Поэтому на катоде будет происходить восстановление молекул воды, сопровождающееся выделением водорода и образованием в прикатодном пространстве гидроксид- ионов ОН—. Имеющиеся у катода ионы натрия Na+ совместно с ионами ОН— будут образовывать раствор щелочи NaOH.
На аноде возможны следующие реакции:(+)А: 2 SO42- — 2 ē → S2O82-
2 H2O — 4 ē → 4H+ + O2.
На аноде в первую очередь протекает реакция с наименьшим значением электродного потенциала. Поэтому на аноде будет протекать окисление молекул воды с выделением кислорода, а в прианодном пространстве накапливаются ионы Н+. Имеющиеся у анода ионы SO42- с ионами Н+ будут образовывать раствор серной кислоты H2SO4.
Суммарная реакция электролиза выражается уравнением:
2 Na2SO4 + 6H2O = 2H2 + 4 NaOH + O2 + 2H2SO4.
катодные продукты анодные продукты
При замене угольного (инертного) анода на медный на аноде становится возможным протекание еще одной реакции окисления – растворение меди:
Cu – 2 ē → Cu2+
Этот процесс характеризуется меньшим значением потенциала, чем остальные возможные анодные процессы. Поэтому при электролизе Na2SO4 с медным анодом на аноде пройдет окисление меди, а в анодном пространстве будет накапливаться сульфат меди CuSO4. Cуммарная реакция электролиза выразится уравнением:
Na2SO4 + 2H2O + Cu = H2 + 2 NaOH + CuSO4.
катодные продукты анодный продукт
Пример 11. Составьте уравнение процессов, протекающих при электролизе водного раствора хлорида никеля NiCl2 с инертным анодом.
30
Решение: В растворе хлорида никеля в электродных процессах могут участвовать ионы никеля Ni2+, Cl— и молекулы воды. В качестве инертного анода можно использовать графитовый электрод.
На катоде возможны следующие реакции:
(-) К: Ni2+ + 2 ē → Ni
2H2O + 2 ē → H2 + 2 OH—
Потенциал первой реакции выше, поэтому на катоде протекает восстановление ионов никеля.
На аноде возможны следующие реакции:
(+) А: 2 Cl— — 2 ē → Cl2
2H2O – 4 ē O2 + 4 H+.
Согласно величинам стандартных электродных потенциалов на аноде
должен выделяться кислород. В действительности, из-за высокого перенапряжения кислорода на электроде выделяется хлор. Величина перенапряжения зависит от материала, из которого изготовлен электрод. Для графита перенапряжение кислорода составляет 1,17 В при плотности тока равной 1а/см2, что повышает потенциал окисления воды до 2,4 В.
Следовательно, электролиз раствора хлорида никеля протекает с образованием никеля и хлора:
Ni2+ + 2Cl— = Ni + Cl2.
на катоде на аноде
Пример 12. Вычислить массу вещества и объем газа, выделившихся на инертных электродах при электролизе водного раствора нитрата серебра AgNO3, если время электролиза составляет 25 мин, а сила тока 3 А.
Решение. При электролизе водного раствора AgNO3 в случае с нерастворимым анодом (например, графитовый) на электродах протекают процессы:
(-) К: Ag+ + ē → Ag ,
2H2O + 2 ē → H2 + 2OH— .
Потенциал первой реакции выше, поэтому на катоде протекает восстановление ионов серебра.
(+) A: 2H2O – 4 ē O2 + 4 H+,
анион NO3— не окисляем.
31
Анодные и катодные процессы связаны между собой: восстановление на катоде идет в той мере, в какой идет окисление на аноде. Другими словами, число электронов в анодной и катодной реакции должно быть одинаково, следовательно, катодную реакцию необходимо домножить на 4.
Суммарное уравнение электролиза нитрата серебра AgNO3:
4 AgNO3 + 2H2O = 4Ag + O2 + 4HNO3
на катоде анодные продукты
На катоде выделяется серебро. Эквивалентная масса cеребра г/моль. Массу серебра рассчитываем по первому закону Фарадея:. На аноде образуется кислород. Эквивалентная масса кислородаг/моль. Массу кислорода рассчитываем по второму закону Фарадея:, откудаг или в литрахл.
studfiles.net
правило Ленца, уравнения Максвелла в интегральной форме, электромагнитная индукция
В статье расскажем что такое электромагнитная индукция, подробно опишем закон Фарадея и правило Ленца, а так же немного затронем тему уравнений Максвелла.
Электромагнитная индукция
Суть электромагнитной индукции заключается в том, что изменение магнитного поля, покрывающего электрическую цепь, вызывает возникновение электродвижущей силы в этой цепи, которая в случае замкнутой цепи вызывает протекание электрического тока. Если цепь, в которой мы должны генерировать электродвижущую силу, состоит из катушки и прикрепленного к ней амперметра, то источник изменяющегося магнитного поля, который включает в себя катушку, может быть адекватно перемещен постоянным магнитом или движущимся электромагнитом, в котором мы меняем ток питания. В каждом из этих случаев магнитное поле, которое пронизывает катушку, изменяется со временем.
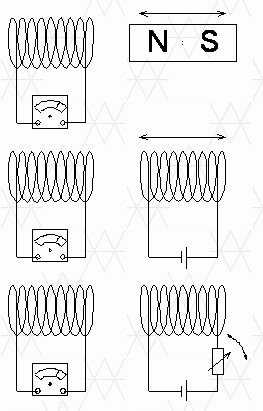
В общем, изменение магнитного потока в цепи амперметра вызывает электрический ток в этой цепи.
Источником индуктивных явлений снова является сила Лоренца F, которая возникает, когда заряд q движется со скоростью v в магнитном поле B
F = q * v * B
Когда направляющая перемещается в поле B, подвижные носители нагрузки будут смещаться под действием силы Лоренца до тех пор, пока в проводнике не появится электрическое поле E, а сила, действующая на носители, F = q * E, уравнивает силу Лоренца. Когда линейный проводник длины l движется с постоянной скоростью v в однородном магнитном поле B, направленном перпендикулярно оси проводника и вектору скорости v , как на чертеже:

тогда мы сохраним условие баланса между силой Лоренца и силой отталкивания между зарядами в виде уравнения:
q*v*B = q*E ,
следовательно
v*B = E = V / l ,
где V — разность потенциалов на концах проводника длиной l. Следовательно, значение этой разности потенциалов:
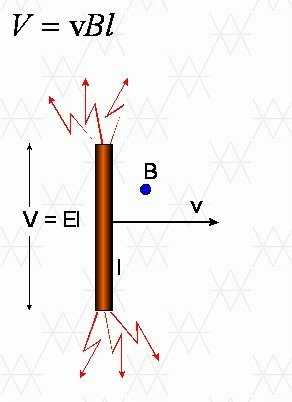
Если вектор v не перпендикулярен полю B , но образует с ним угол N , то разность потенциалов на концах направляющей будет:
V = v * B * l * sin θ
Это означает, что перемещение проводника вдоль направления поля B не будет генерировать в нем электродвижущую силу. Нетрудно доказать, что в случае направляющей любой формы разность потенциалов между точками а и b направляющей равна:
Когда прямоугольная рамка со сторонами a и b вращается в однородном магнитном поле B с постоянной угловой скоростью T
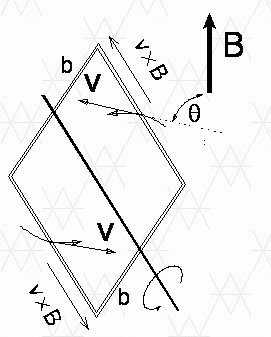
это электродвижущая сила V, генерируемая с обеих сторон рамы:
Магнитные силы, действующие в двух других сторонах петли, перпендикулярны этим сторонам и не влияют на электродвижущую силу. Посредством соответствующего способа получения генерируемого напряжения можно реализовать простейшие модели генераторов переменного тока (а) и постоянного тока (b), как показано на рисунке:
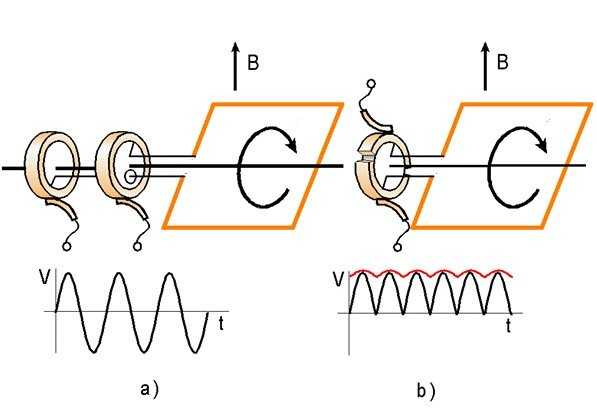
В природе и технике существует огромное количество явлений, вызванных электромагнитной индукцией, то есть генерацией электродвижущей силы в пространстве, где существует изменяющееся магнитное поле. Все эти явления описываются одним замечательным, компактным уравнением, являющимся содержанием закона Фарадея.
Формулы и объяснение закона Фарадея
Большое открытие Майкла Фарадея (1791 — 1867) состояло в том, что он нашел правило, управляющие электромагнитной индукцией. В результате многолетних экспериментов Фарадей заявил, что электродвижущая сила E появляется в проводнике при изменении магнитного поля, окружающего этот проводник, величина генерируемой электродвижущей силы пропорциональна скорости магнитного поля, и что направление индуцированной электродвижущей силы зависит от направления, в котором изменяется магнитное поле. Все эти факты содержатся только в одном уравнении:
где dΦ B — элементарный поток магнитного поля
В общем случае, даже когда проводников нет, электродвижущая сила равна циркуляции электрического поля E вдоль замкнутого контура:
Таким образом , закон Фарадея может быть записан в обобщенной форме:
Обратите внимание, сколько факторов может изменить значение потока:
1. Изменение значения вектора B ;
2. Изменение значения площади поверхности d A ;
3. Путем изменения угла между B и d А ;
4. Одновременное изменение B и d А ;
5. Одновременное изменение В и угла ;
6. Одновременное изменение d A и угла.
Нельзя не заметить появившийся здесь знак минус! Этот знак минус в законе Фарадея был назван правилом Ленца, который можно понимать как правило неповиновения в электродинамике.
Правило Ленца
Правило Ленца (знак минуса в законе Фарадея) определяет, что индукционный электрический ток в проводнике, возникающий при изменении магнитного потока, направлен таким образом, что его магнитное поле противодействует изменению магнитного потока.
Закон индукции Фарадея вместе с правилом Ленца представляет собой анимацию, в которой движение постоянного магнита вызывает создание электродвижущей силы в катушке, покрытой полем магнита.

Индукционный ток может создаваться не только в обмотках, но и в сплошных металлических блоках, помещенных в изменяющиеся магнитные поля.
Пример: так называемый вихревой ток, схематически показанный на рисунке:
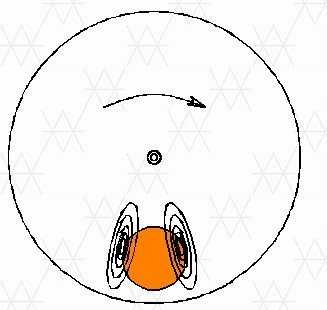
Когда постоянное магнитное поле приложено к вращающейся алюминиевой мишени, то в мишени создаются два семейства противоположно направленных токов. Магнитное поле вихревых токов направлено так, что часть диска, которая выходит из поля, будет втянута обратно в поле, а часть диска, которая входит в область поля, будет вытеснена из этого поля.
Вихревые токи часто нежелательны, например, в сердечниках трансформатора, где они вызывают потери тепла. Для ограничения вихревых токов сердечники трансформатора выполнены в виде стопок из листового металла.
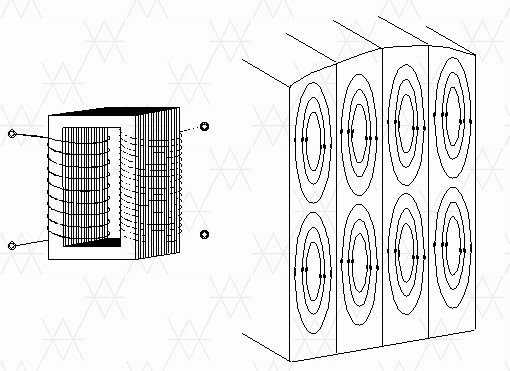
Уравнения Максвелла в интегральной форме
Закон Фарадея содержит: обобщенный закон Ампера, закон Гаусса для электрического поля и закон Гаусса для магнитного поля в системе из четырех уравнений Максвелла. Эти уравнения были представлены применительно к макроскопическим контурам и замкнутым поверхностям. По этой причине мы говорим, что это уравнения Максвелла в интегральной форме. Давайте посмотрим на эти уравнения еще раз.
Закон Фарадея
Обобщенный закон Ампера
Закон Гаусса для электрического поля
Закон Гаусса для магнитного поля
Интегральные уравнения Максвелла описывают электрические и магнитные явления в макроскопическом масштабе. Ведь для их формулировки нужны контуры, замкнутые поверхности, токи и потоки полей. Однако чрезвычайно важно знать, что происходит с электрическими и магнитными полями в отдельных точках, то есть в микроскопическом масштабе. Тогда можно будет описать такие явления как электромагнитные волны.
Для микроскопического описания электрических и магнитных явлений используются уравнения Максвелла в дифференциальной форме. Чтобы получить их, мы применим две математические теоремы к уравнениям в интегральной форме: теорема Гаусса-Остроградского и теорема Стокса.
Следует отметить, что преобразование уравнений Максвелла между целочисленной и дифференциальной формами получается в результате только математических операций. Это означает физическую эквивалентность этих двух форм уравнений Максвелла.
Теорема Гаусса-Остроградского и теорема Стокса, несмотря на их кажущуюся сложность, концептуально совершенно просты и легко интуитивно принимаются. Обе эти тему будут представлены в следующей статье.
meanders.ru
Закон Фарадея для электролиза: формулы
Содержание:
- Суть процесса электролиза
- Первый закон Фарадея
- Второй закон Фарадея
- Видео
Электрический ток, проходящий через растворы электролитов, способствует разложению веществ и дает возможность получать химически чистые материалы. Данный процесс получил наименование электролиза, нашедшего широкое применение в промышленном производстве. Физические преобразования проводников, находящихся в жидкости, объясняет закон Фарадея для электролиза, на основании которого анод выполняет функцию положительного электрода, а катод – отрицательного.
С помощью этого явления осуществляется не только очистка металлов от примесей, но и выполняется нанесение тонких покрытий, защищающих и украшающих металлические поверхности.
Суть процесса электролиза
Электролизом называются процессы окислительно-восстановительных реакций, протекающие под принудительным воздействием электрического тока. Для его выполнения используется специальная емкость с электролитическим раствором, куда погружаются металлические штыри, соединенные с наружным источником питания.
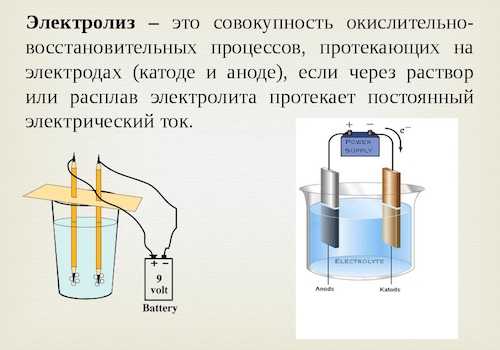
Электрод, соединенный с полюсом отрицательного значения источника тока, считается катодом. Именно в данном месте частицы электролита восстанавливаются. Другой электрод подключается к плюсовому полюсу и носит название анода. На этом участке вещество электрода или частицы электролита окисляются. Химические реакции на этом участке происходят по-разному, в зависимости от материала анода и состава электролитического раствора. Поэтому, как утверждает химия, электроды по отношению к электролиту могут быть инертными или растворимыми.
К категории инертных относятся аноды, изготовленные из материала, не окисляющегося во время электролиза. В качестве примера можно привести графитовые или платиновые электроды. Растворимыми являются практически все остальные виды металлических анодов, подверженных окислению в ходе электролитической реакции.
Электролитами чаще всего служат различные виды растворов или расплавов, внутри которых происходит хаотичное движение заряженных частиц – ионов. Когда на них воздействует электрический ток, они начинают двигаться в определенном направлении: катионы – к катоду, анионы – к аноду. Попадая на электроды, они теряют свои заряды и оседают на них.

Таким образом, на катоде и аноде происходит накопление так называемых суммарных продуктов, состоящих из электрически нейтральных веществ. Весь процесс электролиза выполняется под напряжением, подаваемым на электроды. Данное напряжение Uэл-за является типичным примером разности потенциалов, требующейся для обеспечения нормального течения электролитических реакций. Чисто теоретически это напряжение принимает вид формулы: Uэл-за = Еа – Ек, в которой Еа и Ек являются потенциалами химических реакций, происходящих на аноде и катоде.
Существует определенная связь между количеством электричества, протекавшего через раствор, и количеством вещества, выделенного в период электролитической реакции. Данное явление было описано английским физиком Фарадеем и оформлено в виде двух законов.
Первый закон Фарадея
Данный закон был выведен ученым экспериментальным путем. Он определяет пропорциональную зависимость между массой вещества, образующегося на электроде и зарядом, проходящим через электролитический раствор.
Эту пропорцию наглядно отображает формула m=k х Q=k х I х t, где k является коэффициентом пропорциональности или электрохимическим эквивалентом, Q – заряд, прошедший через электролит, t – время прохождения заряда, m – масса вещества, образовавшегося на электроде в результате реакции.

Первый закон Фарадея служит для определения количества первичных продуктов, образовавшихся в процессе электролиза на электродах. Масса этого вещества составляет суммарную массу всех ионов, попавших на электрод. Это подтверждается формулой m=m0 х N = m0 х Qq0 = m0q0 х I х t, в которой m0 и q0 соответственно являются массой и зарядом единичного иона. N=Qq0 – определяет количество ионов, попавших на электрод за время прохождения заряда Q через раствор электролита.
Следовательно, величина электрохимического эквивалента k представляет собой соотношение массы иона m0 используемого вещества и заряда q0 этого иона. Известно, что величина заряда иона составляет произведение валентности n этого вещества и элементарного заряда е, то есть, q0 = n х e. Исходя из этого, электрохимический эквивалент k будет выглядеть следующим образом: k = m0q0 = m0 х NAn х e х NA = 1F х μn. В этой формуле NA является постоянной Авогадро, μ – молярной массой данного вещества. F = e х NA является постоянной Фарадея и составляет 96485 Кл/моль.
Числовое значение данной величины равняется заряду, который должен быть пропущен через раствор электролита, для того чтобы на электроде выделился 1 моль вещества с одинаковой валентностью. Рассматриваемый закон Фарадея для электролиза примет вид еще одной формулы: m = 1F х μn х I х t.
Второй закон Фарадея
Следующий закон ученого Фарадея описывает, как электрохимический эквивалент будет зависеть от атомной массы вещества и его валентности. У этого коэффициента будет прямая пропорциональная зависимость с атомным весом и обратно пропорциональная – с валентностью вещества. С введением данной величины, второй закон Фарадея формулируется как пропорция электрохимических эквивалентов вещества и собственных химических эквивалентов этих веществ.

Если значения электрохимических эквивалентов взять за k1, k2, k3…kn, а химические эквиваленты принять за х1, х2, х3…xn, то k1/x1 = k2/x2 = k3/x3…kn/xn. Данное соотношение является постоянной величиной, одинаковой для любых используемых веществ: с = k/x и составляет 0,01036 мг-экв/к. Именно такое количество вещества в миллиграмм-эквивалентах выделяется на электродах за период прохождения в электролите электрического заряда, равного одному кулону.
Следовательно, второй закон Фарадея можно представить в виде формулы: k = cx. Если данной выражение использовать вместе с первым законом Фарадея, то в результате получится следующее выражение: m = kq = cxq = cxlt. Здесь категория с представляет собой универсальную постоянную, в размере 0,00001036 г-экв/к. Подобная формулировка дает возможность понять, что одни и те же токи, пропущенные через одинаковый промежуток времени в двух различных электролитах, выделят из них вещества с соблюдением рассмотренного химического эквивалента.
Поскольку x = A/n, то масса выделяемого вещества будет выглядеть как m = cA/nlt, с соблюдением прямой пропорции с атомным весом и обратной пропорции с валентностью.
electric-220.ru
Закон электромагнитной индукции (закон Фарадея).
Федун В.И. Конспект лекций по физике Электромагнетизи
Лекция 26.
Электромагнитная индукция. Открытие Фарадея.
В 1831 г. М. Фарадеем было сделано одно из важнейших фундаментальных открытий в электродинамике – обнаружено явлениеэлектромагнитной индукции.
В замкнутом проводящем
контуре при изменении магнитного потока
(потока вектора 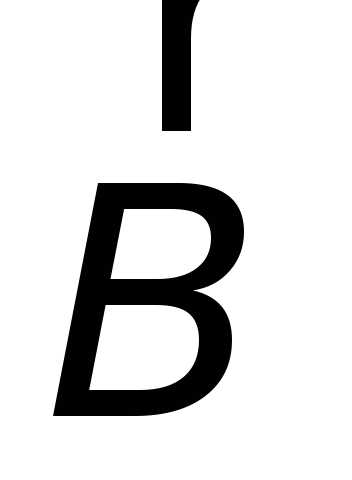 ),
охватываемого этим контуром, возникает
электрический ток.
),
охватываемого этим контуром, возникает
электрический ток.
Этот ток получил название индукционного.
Появление индукционного тока означает, что при изменении магнитного
Фарадей обнаружил, что индукционный ток можно вызвать двумя различными способами, которые удобно объяснить с помощью рисунка.
1-й способ: перемещение рамки  в магнитном поле неподвижной катушки
в магнитном поле неподвижной катушки (см.
рис.26.1).
(см.
рис.26.1).
2-й способ: изменение магнитного поля  ,
создаваемого катушкой
,
создаваемого катушкой ,
за счет ее движения или вследствие
изменения силы тока
,
за счет ее движения или вследствие
изменения силы тока в ней (или того и другого вместе). Рамка
в ней (или того и другого вместе). Рамка при этом неподвижна.
при этом неподвижна.
В обоих этих случаях гальванометр  будет показывать наличие индукционного
тока в рамке
будет показывать наличие индукционного
тока в рамке .
.
Направление индукционного тока и,
соответственно, знак э.д.с. индукции  определяются правилом Ленца.
определяются правилом Ленца.
Правило Ленца.
Индукционный ток всегда направлен так, чтобы противодействовать причине, его вызывающей.
Правило Ленца выражает важное физическое свойство – стремление системы противодействовать изменению ее состояния. Это свойство называют электромагнитной инерцией.
Какова бы ни была причина изменения магнитного потока, охватываемого замкнутым проводящим контуром, возникающая в контуре э.д.с. индукции определяется формулой
| (26.1) |
Природа электромагнитной индукции.
С целью выяснения физических причин, которые приводят к возникновению э.д.с. индукции, последовательно рассмотрим два случая.
1. Контур движется в постоянном магнитном поле.
Пусть контур
с подвижной перемычкой длиной | |
Рисунок 26.2 |
действовать сила
, |
вызывающая перемещение электронов по перемычке вниз, т.е. потечет ток, направленный вверх.
Перераспределившиеся заряды создадут электрическое поле, которое возбудит ток и в остальных участках контура.
Это и есть индукционный ток.
Магнитная сила  играет роль сторонней силы. Ей можно
сопоставить эквивалентное поле сторонних
сил
играет роль сторонней силы. Ей можно
сопоставить эквивалентное поле сторонних
сил
| (26.2) |
Электродвижущая сила,
создаваемая этим полем, называется электродвижущей
силой индукции  .
В нашем случае
.
В нашем случае
. | (26.3) |
Здесь знак «минус» поставлен
потому, что стороннее поле  направлено против положительного обхода
контура, определяемого правилом правого
винта. Произведение
направлено против положительного обхода
контура, определяемого правилом правого
винта. Произведение есть скорость приращения площади контура
(приращение площади в единицу времени),
поэтому
есть скорость приращения площади контура
(приращение площади в единицу времени),
поэтому
, |
где  — приращение магнитного потока сквозь
контур.
— приращение магнитного потока сквозь
контур.
Тогда,
| (26.4) |
Полученный результат можно обобщить
на случай произвольной ориентации
вектора индукции магнитного поля  относительно плоскости контура и на
любой контур, движущийся (и/или
деформируемый) произвольным образом в
постоянном неоднородном внешнем
магнитном поле.
относительно плоскости контура и на
любой контур, движущийся (и/или
деформируемый) произвольным образом в
постоянном неоднородном внешнем
магнитном поле.
Итак, возбуждение э.д.с. индукции при
движении контура в постоянном магнитном
поле объясняется действием магнитной
составляющей силы Лоренца, пропорциональной  ,
которая возникает при перемещении
проводника.
,
которая возникает при перемещении
проводника.
2. Контур покоится в переменном магнитном поле.
Наблюдаемое на опыте возникновение индукционного тока свидетельствует о том, что и в этом случае в контуре появляются сторонние силы, которые теперь связаны с изменяющимся во времени магнитным полем. Какова же их природа? Ответ на этот принципиальный вопрос был дан Максвеллом.
Поскольку проводник покоится, то скорость
упорядоченного движения электрических
зарядов  и, следовательно, магнитная сила,
пропорциональная
и, следовательно, магнитная сила,
пропорциональная ,
также равна нулю и уже не может привести
заряды в движение. Однако кроме магнитной
силы на электрический заряд может
действовать только сила со стороны
электрического поля, равная
,
также равна нулю и уже не может привести
заряды в движение. Однако кроме магнитной
силы на электрический заряд может
действовать только сила со стороны
электрического поля, равная .
Поэтому остается заключить, чтоиндукционный ток обусловлен
электрическим полем
.
Поэтому остается заключить, чтоиндукционный ток обусловлен
электрическим полем  ,
возникающим при изменении во времени
внешнего магнитного поля. Именно
это электрическое поле и ответственно
за появление э.д.с. индукции в неподвижном
контуре. Согласно Максвеллу,изменяющееся
во времени магнитное поле порождает в
окружающем пространстве электрическое
поле. Возникновение электрического
поля не связано с наличием проводящего
контура, который лишь позволяет обнаружить
по возникновению в нем индукционного
тока существование этого поля.
,
возникающим при изменении во времени
внешнего магнитного поля. Именно
это электрическое поле и ответственно
за появление э.д.с. индукции в неподвижном
контуре. Согласно Максвеллу,изменяющееся
во времени магнитное поле порождает в
окружающем пространстве электрическое
поле. Возникновение электрического
поля не связано с наличием проводящего
контура, который лишь позволяет обнаружить
по возникновению в нем индукционного
тока существование этого поля.
Формулировка закона электромагнитной индукции, данная Максвеллом, принадлежит к числу наиболее важных обобщений электродинамики.
Всякое изменение магнитного поля во времени возбуждает в окружающем пространстве электрическое поле.
Математическая формулировка закона электромагнитной индукции в понимании Максвелла имеет вид:
Циркуляция вектора
напряженности  этого поля по любому неподвижному
замкнутому контуруопределяется выражением
этого поля по любому неподвижному
замкнутому контуруопределяется выражением
| (26.5) |
где  — магнитный поток, пронизывающий контур
— магнитный поток, пронизывающий контур .
.
Используемый для обозначения скорости изменения магнитного потока знак частной производной указывает на то, что контур является неподвижным.
Поток вектора  через поверхность, ограниченную контуром
через поверхность, ограниченную контуром ,
равен
,
равен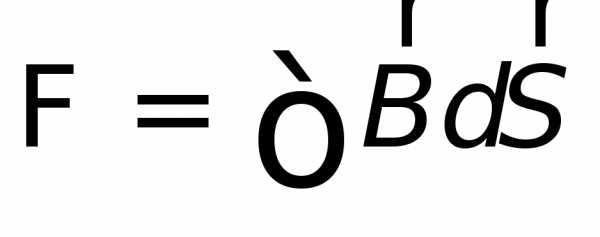 ,
поэтому выражение закона электромагнитной
индукции можно переписать следующим
образом:
,
поэтому выражение закона электромагнитной
индукции можно переписать следующим
образом:
. | (26.6) |
Воспользовавшись теоремой Стокса можно получить закон электромагнитной индукции в дифференциальной форме:
| (26.7) |
Это одно из уравнений системы уравнений Максвелла.
Тот факт, что циркуляция электрического поля, возбуждаемого переменным во времени магнитным полем, отлична от нуля, означает, что рассматриваемое электрическое поле не потенциальное.Оно, как и магнитное поле, являетсявихревым.
В общем случае электрическое поле  может быть представлено векторной
суммой потенциального (поля статических
электрических зарядов, циркуляция
которого равна нулю) и вихревого
(обусловленного изменяющимся во времени
магнитным полем) электрических полей.
может быть представлено векторной
суммой потенциального (поля статических
электрических зарядов, циркуляция
которого равна нулю) и вихревого
(обусловленного изменяющимся во времени
магнитным полем) электрических полей.
В основе рассмотренных нами явлений,
объясняющих закон электромагнитной
индукции, не просматривается общего
принципа, позволяющего установить
общность их физической природы. Поэтому
эти явления следует рассматривать как
независимые, а закон электромагнитной
индукции — как результат их совместного
действия. Тем более удивительным
оказывается тот факт, что э.д.с. индукции
в контуре всегда равна скорости изменения
магнитного потока сквозь контур. В тех
случаях, когда меняется и поле  и расположение или конфигурация контура
в магнитном поле, э.д.с. индукции следует
рассчитывать по формуле
и расположение или конфигурация контура
в магнитном поле, э.д.с. индукции следует
рассчитывать по формуле
| (26.8) |
а закон электромагнитной индукции можно представить в виде
. | (26.9) |
Выражение, стоящее в правой части этого равенства, представляет собой полную производную магнитного потока по времени: первое слагаемое связано с изменением магнитного поля во времени, второе – с движением контура.
Можно сказать, что во всех случаях индукционный ток вызывается полной силой Лоренца
. |
Какая часть индукционного тока вызывается электрической, а какая магнитной составляющей силы Лоренца — зависит от выбора системы отсчета.
О работе сил Лоренца и Ампера.
Из самого определения работы следует, что сила, действующая в магнитном поле на электрический заряд и перпендикулярная его скорости, не может совершать работы. Однако при движении проводника с током, увлекающего за собой заряды, сила Ампера все же работу совершает. Наглядным подтверждением этого служат электромоторы.
Это противоречие исчезает, если принять во внимание, что движение проводника в магнитном поле неизбежно сопровождается явлением электромагнитной индукции. Поэтому наряду с силой Ампера работу над электрическими зарядами совершает и возникающая в проводнике электродвижущая сила индукции. Т.о., полная работа сил магнитного поля складывается из механической работы, обусловленной силой Ампера, и работы э.д.с., индуцируемой при движении проводника. Обе работы равны по модулю и противоположны по знаку, поэтому их сумма равна нулю. Действительно, работа амперовой силы при элементарном перемещении проводника с током в магнитном поле равна , за это же время э.д.с. индукции совершает работу
, | (26.10) |
тогда полная работа .
Силы Ампера совершают работу не за счет энергии внешнего магнитного поля, которое может оставаться постоянным, а за счет источника э.д.с., поддерживающего ток в контуре.
studfiles.net
1.4. Законы Фарадея (законы электролиза)
Связь между количеством выделившегося при электролизе веществ и количеством электричества, прошедшего через электролит, выражается двумя законами Фарадея.
Первый закон Фарадея. Масса вещества, выделившегося на электроде при электролизе, прямо пропорциональна количеству электричества, прошедшего через электролит:
m = kQ,
где m — масса вещества, г; k – электрохимический эквивалент, т.е. масса вещества, выделившаяся при прохождении одного кулона электричества, г/Кл; Q – количество электричества, Кл (Q = It, где I — сила тока, t — время, с).
Второй закон Фарадея. Одинаковое количество электричества выделяет при электролизе на электродах эквивалентные массы различных веществ. Для выделения одного моля эквивалента любого вещества необходимо затратить одно и то же количество электричества, а именно 96485 Кл, называемое числом Фарадея.
Тогда электрохимический эквивалент:
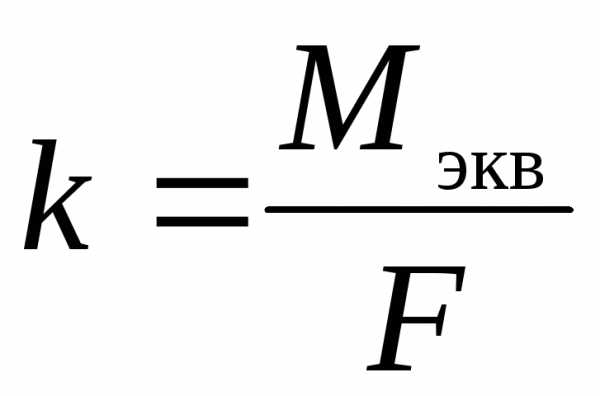 ,
,
где Mэкв — молярная масса химического эквивалента вещества (иона), г/моль экв.
Из первого и второго законов Фарадея вытекает объединенное уравнение:
;
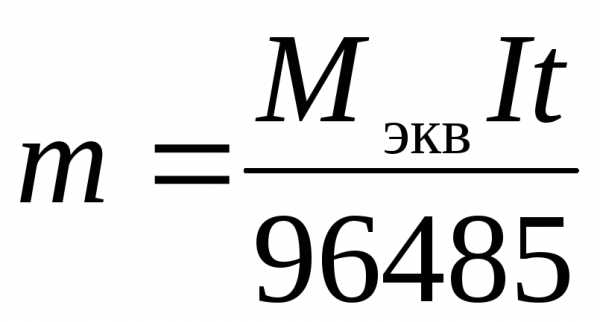 .
(4)
.
(4)
1.5. Примеры решения задач
Пример 1. Написать уравнения электрохимических процессов, происходящих на аноде (анод инертный) и катоде при электролизе раствора бромида меди (II).
Решение. В водном растворе CuBr2 диссоциирует следующим образом:
CuBr2←→ Cu2+ + 2Br –.
Стандартный электродный потенциал водородного электрода в нейтральной водной среде:
2H2O + 2ē → H2↑ + 2OH– (–0,41В).
Это значительно отрицательнее потенциала системы:
Cu2+ + 2e → Cu0 (+0,34В).
Поэтому на катоде будет происходить электрохимическое осаждение меди:
Cu2+ + 2ē → Cu0.
На аноде будет происходить окисление ионов брома, приводящее к выделению газообразного брома:
Br – – ē → Br0 ;
2Br0 → Br2↑;
поскольку электрохимическое окисление воды:
2H2O – 4e → O2↑ + 4H+
из нейтральных сред может протекать при потенциалах не менее (+1,23 В), что выше стандартного электродного потенциала, характеризующего выделение газообразного брома (+1,07 В).
Пример 2. Написать уравнения электрохимических процессов, происходящих на аноде и катоде при электролизе раствора сульфата натрия (анод инертный).
Решение. В водном растворе Na2SO4 диссоциирует следующим образом:
Na2SO4←→ 2Na+ + SO42–.
Стандартный электродный потенциал системы:
Na+ + ē → Na0 (–2,71 В)
значительно отрицательнее потенциала водородного электрода в нейтральной среде (–0,41 В). Поэтому на катоде будет происходить электрохимическое разложение воды с выделением водорода:
2H2O + 2ē → H2↑ + 2OH–,
а ионы натрия, приходящие к катоду, будут накапливаться в прилегающей к нему части раствора (катодное пространство).
На аноде будет происходить электрохимическое окисление воды, приводящее к выделению кислорода:
2H2O – 4e → O2↑ + 4H+,
поскольку отвечающей этой системе стандартный электродный потенциал (+1,23 В) значительно ниже, чем стандартный электродный потенциал (+2,01 В), характеризующий систему:
2SO42– – 2ē → S2O82–.
Сульфат-ионы, движущиеся при электролизе к аноду, будут накапливаться в анодном пространстве.
Пример 3. Написать уравнения электрохимических процессов, происходящих на катоде и аноде при электролизе раствора сульфата цинка с цинковым анодом.
Решение. В водном растворе ZnSO4 диссоциирует следующим образом:
ZnSO4←→ Zn2+ + SO42–.
Стандартный электродный потенциал системы:
Zn2+ + 2ē → Zn0 (–0,76 В)
близок к потенциалу водородного электрода в нейтральной водной среде (– 0,41 В), поэтому на катоде будут совместно протекать два процесса восстановления:
Zn2+ + 2ē → Zn0;
2H2O + 2ē → H2↑ + 2OH–.
На аноде возможно протекание трех окислительных процессов: электрохимического окисления воды, приводящего к выделению кислорода (+1,23 В), окисления сульфат-ионов (+2,01 В) и окисления материала анода, т.е. цинка (–0,76 В). Сравнение электродных потенциалов систем позволяет сделать вывод об окислении анода и выделении ионов цинка в раствор:
Zn0 – 2ē → Zn2+.
Пример 4. Определить массу цинка, которая выделится на катоде при электролизе сульфата цинка в течение одного часа при токе 26,8 А, если выход по току цинка равен 50 %.
Решение. Расчет ведем согласно объединенному уравнению из законов Фарадея (4). Масса моля эквивалента (химический эквивалент вещества) цинка в ZnSO4 равна (65,38 / 2) = 32,69 г/моль экв. Не забыв выразить время в секундах, подставим в уравнение закона Фарадея все известные значения и определим массу цинка, которая должна выделиться (при условии, если весь ток будет израсходован на выделение цинка):
m = (32,69 ∙ 26,8 ∙ 3600) / 96485 = 32,69 г.
Так как выход по току цинка составляет 50%, то практически на катоде выделится цинка:
mпр = 32,69 ∙ (50/100) = 16,345 г.
Пример 5. Рассчитать ток при электролизе раствора в течение 1 ч 40 мин 25 с, если на катоде выделилось 1,4 л водорода, измеренного при нормальных условиях.
Решение. Из формулы (4) выразим силу тока:
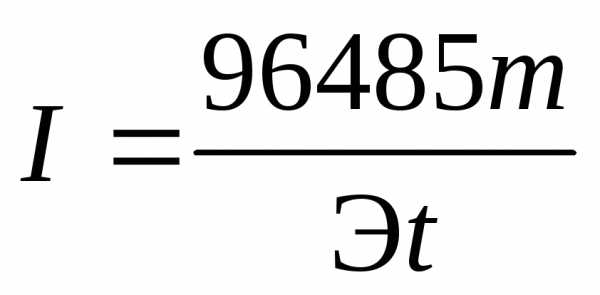 .
.
Так как количество водорода дано в единицах объема, то отношение m/Э заменяем отношением VH2/Vэкв H2 , где VH2 — объем водорода, л; Vэкв H2 — объем одного моля эквивалента водорода. Объем моля эквивалента водорода при нормальных условиях равен половине моля молекул водорода Vэкв H2 = 22,4/2 = 11,2 л, так как моль любого газа в нормальных условиях занимает объем, равный 22,4 л, а в процессе электрохимического восстановления водорода участвуют два электрона. Подставив в приведенную формулу числовые значения, получим:
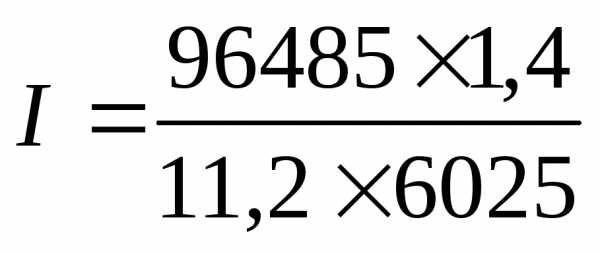 =
2 А.
=
2 А.
studfiles.net
Закон Фарадея для электромагнитной индукции в трансформаторах
Электричество обладает способностью генерировать магнитное поле. В 1831 году М. Фарадей ввел понятие электромагнитная индукция. Он смог получить в закрытой системе проводников электричество, появляющееся при изменении показателей магнитного потока. Формула закона Фарадея дала толчок для развития электродинамики.

История развития
После доказательства закона электромагнитной индукции английским ученым М. Фарадеем над открытием работали российские ученые Э. Ленц и Б. Якоби. Благодаря их трудам, сегодня разработанный принцип положен в основу функционирования многих приборов и механизмов.
Основными агрегатами, в которых применяется закон электромагнитной индукции Фарадея, являются двигатель, трансформатор и множество иных приборов.
Индукцией электромагнитно именуется индуцирование в замкнутой проводящей системе электрического тока. Такое явление становится возможным при физическом передвижении через проводниковую систему магнитного поля. Механическое действие влечет за собой появление электричества. Его принято называть индукционным. До открытия закона Фарадея человечество не знало об иных способах создания электричества, кроме гальваники.
Если сквозь проводник пропустить магнитное поле, в нем будет возникать ЭДС индукции. Ее еще именуют электродвижущей силой. При помощи этого открытия удается представить в количественном выражении показатель.
Опытное доказательство
Проводя свои исследования, английский ученый установил, что индукционный ток получается одним из двух способов. В первом опыте он появляется при движении рамки в магнитном поле, создаваемом неподвижной катушкой. Второй способ предполагает неподвижное положение рамки. В этом эксперименте изменяется только поле катушки при ее движении или изменении силы тока в ней.
Опыты Фарадея привели исследователя к выводу, что при генерировании индукционного тока провоцируется увеличением или уменьшением магнитного потока в системе. Также опыты Фарадея позволили утверждать, что значение электричества, полученного опытным путем, не зависит от методологии, которой был изменен поток магнитной индукции. На показатель влияет только скорость такого изменения.
Количественное выражение
Установить количественное значение явления электромагнитной индукции позволяет закон Фарадея. Он гласит, что ЭДС, определяющаяся в системе, меняет значение пропорционально скорости перемещения потока в проводнике. Формула будет иметь такой вид:
Отрицательный знак свидетельствует о том, что ЭДС препятствует появлению изменений внутри контура. Для решения некоторых задач отрицательный знак в формуле не ставят. В этом случае результат записывают в виде модуля.
Система может включать в себя несколько витков. Количество их обозначается латинской буквой N. Все элементы контура пронизываются единым магнитным потоком. ЭДС индукции будет рассчитываться так:
Понятным примером воссоздания электричества в проводнике считается катушка, сквозь которую перемещается постоянный магнит.
Работа Э. Ленца
Направленность индукционного тока предоставляет возможность определить правило Ленца. Краткая формулировка звучит достаточно просто. Появляющийся при изменении показателей поля проводникового контура ток, препятствует благодаря своему магнитному полю такому изменению.
Если в катушку постепенно вводить магнит, в ней повышается уровень магнитного потока. Согласно правилу Ленца, магнитное поле будет иметь направление противоположное увеличению поля магнита. Чтобы понять эту направленность, необходимо смотреть на магнит с северной стороны. Отсюда будет вкручиваться буравчик навстречу северному полюсу. Ток будет перемещаться в сторону движения часовой стрелки.
Если магнит выводится из системы, магнитный поток в ней уменьшится. Чтобы установить направление тока, выкручивается буравчик. Вращения будет направлено в обратную сторону перемещения по циферблату часовой стрелки.
Формулировки Ленца приобретают большое значение для системы с контуром замкнутого типа и отсутствующим сопротивлением. Его принято именовать идеальным контуром. По правилу Ленца, в нем невозможно увеличить или уменьшить магнитный поток.
Понятие самоиндукции
Генерация индукции в идеальной системе, которое имеет место при падении или возрастании электричества в проводнике, именуется самоиндукцией.
Закон Фарадея для самоиндукции выражается равенством, когда при изменении электричества не произошло иных изменений:
где е – ЭДС, L – индуктивность закрытой катушки, ΔI/Δt – скорость, с которой происходят изменения силы тока.
Индуктивность
Отношение, которое показывает пропорциональность между такими категориями, как сила тока в проводящей системе и магнитным потоком именуется индуктивностью. На показатель имеет влияние физические габариты катушки и магнитные характеристики среды. Отношение описывается формулой:
Движущееся в контуре электричество провоцирует появление магнитного поля. Оно пронизывает собственный проводник и влечет появление своего потока сквозь контур. Причем собственный поток пропорционален электричеству, которая его порождает:
Фс = L*I
Значение индуктивности также формируется из закона Фарадея.
Недвижимая система
Сила Лоренца объясняет возникновение ЭДС при движении системы в поле со значением постоянным. Индукционная ЭДС имеет способность возникать и при неподвижной проводящей системе, находящейся в переменном магнитном поле. Сила Лоренца в таком примере не способна объяснить появление ЭДС индукции.
Максвелл для проводящих систем неподвижного типа предложил применять особое уравнение. Оно объясняет возникновение в таких системах ЭДС. Главным принципом закона Фарадея-Максвелла является факт, что переменное поле образует в пространстве вокруг себя электрическое поле. Оно выступает фактором, провоцирующим появление тока индукции в недвижимой системе. Перемещение вектора (Е) по стационарным контурам (L) является ЭДС:
При наличии тока переменного значения законы Фарадея водятся в уравнения Максвелла. Причем они могут быть представлены как в дифференциальной форме, так и в виде интегралов.
Труды в области электролиза
При использовании законов Фарадея описываются закономерности, которые существуют при электролизе. Этот процесс заключается в превращении веществ с разнообразными характеристиками. Это происходит при движении электричества сквозь электролит.
Эти закономерности были доказаны М. Фарадеем в 1834 году. Первое утверждение гласит, что масса вещества, которое образуется на электроде, меняется соответственно заряду, перемещенному сквозь электролит.
Второе утверждение гласит, что эквиваленты компонентов с разными характеристиками пропорциональны химическим эквивалентам этих компонентов.
Оба представленных утверждения совмещаются в объединенный закон Фарадея. Из него следует, что число Фарадея будет равняться электричеству, способному выделить на электролите 1 моль вещества. Ее рассчитывают на единицу валентности. Именно по объединенной формуле в далеком 1874 году был вычислен заряд электрона.
Законы электролиза, установленные Фарадеем, тестировались при различном значении тока, температуры, давления, а также при одновременном выделении двух и более веществ. Электролиз также проводился в разных расплавах и растворителях. Концентрация электролита также отличалась в разных опытах. При этом иногда наблюдались небольшие отклонения от закона Фарадея. Они объясняются электронной проводимостью электролитов, которая определяется наравне с ионной проводимостью.
Открытия, сделанные английским физиком М. Фарадеем, позволили описать множество явлений. Его законы являются основой современной электродинамики. По этому принципу функционирует различное современное оборудование.
protransformatory.ru
Законы Фарадея в физике
Законы электролиза
При прохождении электрического тока через электролиты происходит процесс разложения вещества, который называют электролизом. При этом проводники, которые погружены в раствор, называют анодом (положительный электрод) и катодом (отрицательный электрод).
При помощи электролиза получают различные вещества, например, хлор, фтор, щелочи и т.д. При помощи данного процесса производят переработку сырья, которое содержит металлы, очищают металлы. Используя процессы электролиза, наносят тонкие металлические покрытия на разные металлические поверхности.
Формулировка первого закона Фарадея
Масса вещества, которое выделяется на электроде, прямо пропорциональна заряду, который прошел через электролит. В виде формулы данный закон можно представить как:
где — полный заряд, который проходит через электролит, за времяt. — сила тока. — коэффициент пропорциональности (электрохимический эквивалент вещества ()), равный массе вещества, которая выделится при прохождении через электролит заряда равного 1 Кл. Величина является характеристикой вещества.
Первый закон для электролиза был получен Фарадеем экспериментально.
Формулировка второго закона Фарадея
Электрохимический эквивалент пропорционален молярной массе вещества () и обратно пропорционален величине его химической валентности (). В математическом виде второй закон Фарадея записывают как:
где Кл/моль — постоянная Фарадея, полученная эмпирически. Величину называют химическим эквивалентом вещества, она показывает, какая масса вещества требуется для замещения одного моля водорода в химических соединениях.
Иногда второй закон Фарадея формулируют так:
Электрохимические эквиваленты веществ пропорциональны их химическим эквивалентам.
Второй закон Фарадея также относят к эмпирическим законам.
Объединенный закон Фарадея для электролиза
Объединенный закон Фарадея записывают в виде:
Физический смысл выражения (3) заключен в том, что постоянная Фарадея количественно равна заряду, который следует пропустить через всякий электролит для того, чтобы на электродах выделилось вещество в количестве, равном одному химическому эквиваленту.
Примеры решения задач
ru.solverbook.com


 находится в магнитном поле,
перпендикулярном плоскости контура
(см.Рисунок
26.2). Если двигать перемычку со
скоростью
находится в магнитном поле,
перпендикулярном плоскости контура
(см.Рисунок
26.2). Если двигать перемычку со
скоростью вправо, то с такой же скоростью начнут
двигаться и носители тока в перемычке
– электроны. В результате на каждый
электрон начинает
вправо, то с такой же скоростью начнут
двигаться и носители тока в перемычке
– электроны. В результате на каждый
электрон начинает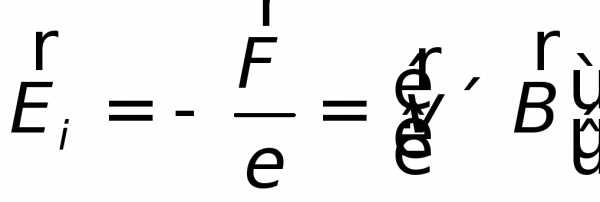 .
.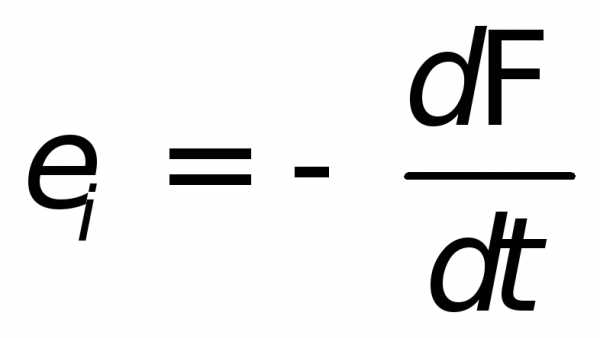 .
.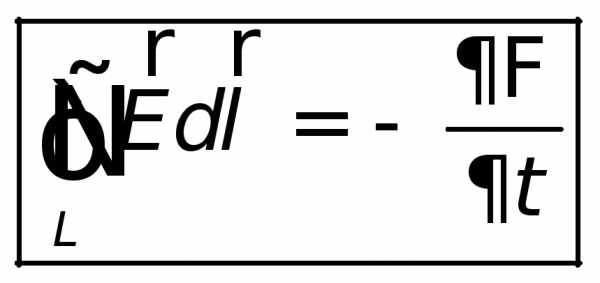 ,
,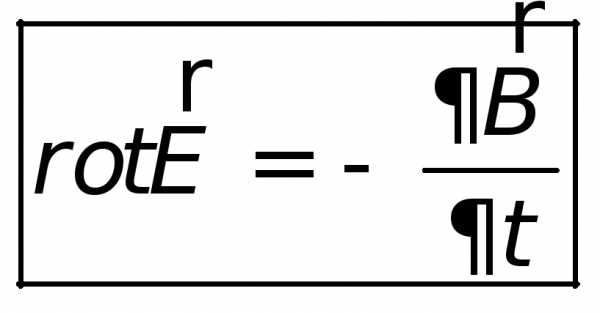 .
.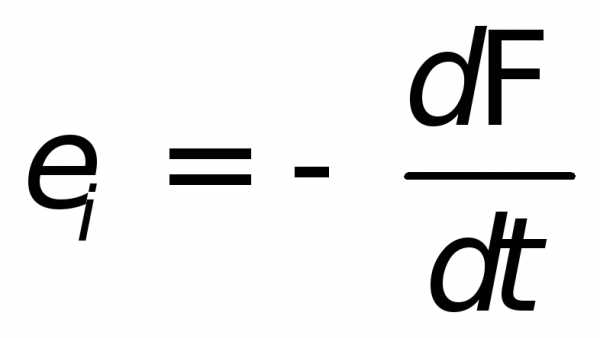 ,
,