Железосинеродистый калий — это… Что такое Железосинеродистый калий?

Гексацианоферрат (III) калия (красная кровяная соль)
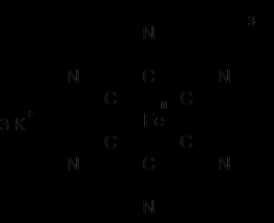
Гексацианоферра́т(III) ка́лия (железосинеро́дистый ка́лий, феррициани́д ка́лия, гексацианоферра́т ка́лия) — комплексное соединение трёхвалентного железа K3[Fe(CN)6].
Тривиальные названия
- красная кровяная соль;
- красное синькали.
История и происхождение названия
В 1822 немецким химиком Леопольдом Гмелином соединение было приготовлено путём окисления «жёлтой кровяной соли». Этот факт, а также красный цвет кристаллов, обусловили происхождение названия.
Свойства
Тёмно-красные кристаллы с моноклинной решеткой. Водный раствор зеленовато-жёлтого цвета.
| Температура, °C | Растворимсть, г/100 г воды |
|---|---|
| 0 | 29,9 |
| 10 | 38,3 |
| 20 | 46 |
| 25 | 48,8 |
| 30 | 52,7 |
| 40 | 59,5 |
| 60 | 70,9 |
| 80 | 81,8 |
| 100 | 91,6 |
В этаноле нерастворим.
Гексацианоферрат(III) калия — очень сильный окислитель, особенно в щелочной среде. Окисляет H2S до S, HI до I2, PbO до PbO2, NH3 до N2 и солей аммония, W до WO42-:
W + 6K3[Fe(CN)6] + 8KOH → 6K4[Fe(CN)6] + K2WO4 + 4H2O
На свету происходит быстрое увеличение значения pH, при помещении в темноту кислотность уменьшается. Это связано со светочуствительностью обратимых реакций:
K3[Fe(CN)6] + H2O ↔ K2[Fe(CN)5OH2] + KCN
KCN + H2O ↔ HCN + KOH
С солями Fe2+ образует темно-синий осадок турнбулевой сини. Уравнение реакции (в ионной форме):
4Fe2+ + 3[Fe(CN)6]3- → FeIII4[FeII(CN)6]3↓
Ранее считалось, что при этом образуется гексацианоферрат(III) железа(II), то есть FeII3[Fe(CN)6]2, именно такую формулу предлагали для «турнбулевой сини». Теперь известно, что турнбулева синь и берлинская лазурь — одно и то же вещество, а в процессе реакции происходит переход электронов от ионов Fe2+ к гексацианоферрат(III) — иону (валентная перестройка Fe2+ + [Fe3+(CN)6] к Fe3+ + [Fe2+(CN)6] происходит практически мгновенно, обратную реакцию можно осуществить в вакууме при 300°C). Соли Fe3+ при этом не мешают, так как дают только слабое зеленовато-коричневое окрашивание (Гексацианоферрат(III) железа(III) Fe
Эта реакция является аналитической и используется для определения ионов Fe2+.
С концентрированной серной кислотой реагирует, давая FeH(SO4)2, KHSO4, NH4HSO4 и CO.
С соляной кислотой реагирует давая осадок железосинеродистой кислоты H3[Fe(CN)6].
Реагирует с перекисью бария (эта реакция может использоваться для количестенного определения BaO2):
BaO2 + 2K3[Fe(CN)6] → K6Ba[Fe(CN)6]2 + O2↑
В отличие от гексацианоферрата(II) калия, гексацианоферрат(III) калия ядовит.
Интересно то, что из гексацианоферрата(III) калия можно получить гексацианоферрат(II) калия с помощью перекиси водорода в щелочной среде.
2K3[Fe(CN)6] + H2O2 + 2KOH → 2K 4[Fe(CN)6] + 2H2O + O2↑
Дело в том, что в нейтральной среде эта реакция протекает в обратную сторону.
Получение
Получают калия гексацианоферрат(III) окислением K4[Fe(CN)6] хлором в солянокислой среде, бромом или другим сильным окислителем, например, перманганатом калия.
Применение
Компонент тонирующих, отбеливающих, усиливающих, ослабляющих растворов в фотографии, электролит в хемотронных приборах, компонент электролитов в гальванопластике, реагент для обнаружения Fe2+ (см. выше), Li+ Sn2+, а также в качестве сильного окислителя.
В почвоведении используют для качественного определения оглеения (солей двухвалентного железа). Химическая реация описана выше.
Мнемонические правила
Для того, чтобы запомнить формулу красной кровяной соли K3[Fe(CN)6] и не перепутать ее с формулой желтой кровяной соли K4[Fe(CN)6], существует несколько мнемонических правил:
- В соли красной кровяной калий с тройкой за стеной. Дальше — феррум, шесть цианов: все готово без обманов.
- Число атомов калия соответствует числу букв в английских названиях солей: «gold» — 4 буквы, то есть 4 атома калия — желтая кровяная соль K4[Fe(CN)6]. «Red» — три буквы, то есть три атома калия — красная кровяная соль — K3[Fe(CN)6].
См. также
Wikimedia Foundation. 2010.
dic.academic.ru
Калий железосинеродистый
Калий железосинеродистый
ГОСТ 4206-75
K3[Fe(CN)6]
Гексацианоферрат(III) калия (железосинеродистый калий, феррицианид калия гексацианоферриат калия, Гмелина соль, красная кровяная соль) — комплексное соединение трёхвалентного железа K 3[Fe(CN)6].
| Систематическое наименование |
Гексацианоферрат(III) калия |
|---|---|
| Традиционные названия |
красная кровяная соль, |
| Хим. формула |
K3[Fe(CN)6] |
| Физические свойства | |
| Состояние |
тёмно-красные кристаллы |
| Молярная масса |
329,25 г/моль |
| Плотность |
1,845 г/см³ |
| Термические свойства | |
| Мол. теплоёмк. |
316,3 Дж/(моль·К) |
| Энтальпия образования |
−173,2 кДж/моль |
| Химические свойства | |
| Растворимость в воде |
48,8 г/100 мл |
Свойства
Темно-красные ромбические призмы (в измельченном виде — желтый порошок), пл. 1,894 г/см3. Реактив растворим в воде (31,5% при 20 °С). В водном растворе соль постепенно на свету переходит в K4[Fe(CN)6].
В щелочной среде K3[Fe(CN)6] является сильным окислителем, способным переводить, например, Сr3+ в CrO42- и Рb2+ в РbО2.
Очистка
Калий железосинеродистый при нагревании с разбавленными сильными кислотами разлагается с выделением синильной кислоты — сильнейшего яда, вдыхание которого опасно для жизни. Поэтому с кислыми растворами K3[Fe(CN)6] следует работать под тягой и в резиновых перчатках.
Препарат, соответствующий реактиву квалификации ч.д.а., удается получить при перекристаллизации технического К 3[Fe(CN)6].
Растворяют 130-135 г K3[Fe(CN)6] (техн.) в 350 мл воды при перемешивании и нагревании не выше 70 °С. Раствор фильтруют и охлаждают. Выпавшие кристаллы отсасывают на воронке Бюхнера, промывают небольшим количеством воды и сушат при комнатной температуре.
Выход 5О г (37-38%). При многократной перекристаллизации с использованием маточных растворов для растворения соли можно повысить выход до 80-90%.
himmax.ru
Красная Кровяная Соль (Название, Применение, Токсичность)
Калий железосинеродистый (krasnaya sol, феррицианид, красное синькали, Гмелина соль, калия гексацианоферриат) – это комплексное соединение трехвалентного железа, представляющее собой темно-красные прозрачные кристаллы.
Красная кровяная соль: почему так называется?
Материал хорошо растворяется в воде, а его водные растворы имеют желтовато-зеленый цвет. Он является сильным окислителем, особенно при нагревании в щелочной среде. Соединение реагирует с кислотами с образом токсичного газа – цианида водорода, а с солями металлов образует нерастворимые осадки.
Где применяется красная кровяная соль?
Калий железосинеродистый используется при производстве электрохимических приборов как электролит, для нахождения ионов железа, олова, никеля, серебра, цезия, кобальта и лития в качестве окислителя.
Материал также может применяться в гальванотехнике для создания металлических копий методом электролиза, получения эффектов тонирования, осветления и усиления изображения при фотопечати как компонент проявителя.
Реагент используют и для получения топлива в пиротехнике, а также для оглеения (распознавания солей двухвалентного железа) в почвоведении, при окрашивании шелка изготовлении цветной бумаги. Он продается по выгодным ценам в нашей организации.
Красная кровяная соль: токсичность
Калий железосинеродистый («ч», ГОСТ, «чда») обладает токсичностью, а при взаимодействии с кислотами начинает разлагаться с выделением сильного яда – циановодорода. По этой причине его нельзя хранить и транспортировать вместе с кислотами.
По степени воздействия на организм продукт относится к третьему классу опасности (умеренно опасные вещества). Им можно отравиться при употреблении внутрь, что способно привести к летальному исходу, так как он начнет взаимодействовать с желудочным соком с образованием синильной кислоты.
Где приобрести?
Если вы хотите покупать химическую продукцию с доставкой в СПБ и другие города России, предлагаем оставить заявку на нашем сайте. Для этого нажмите на соответствующую кнопку ниже и следуйте инструкциям далее.
him-kazan.ru
Калий железосинеродистый (красная кровяная соль)
Химическая формула: K3(Fe(CN)6)
Синоним: Красная кровяная соль, Калия гексацианоферриат
Международное название: POTASSIUM FERRICYANIDE
CAS No: 13746-66-2
Квалификация: Имп. «ч», ГОСТ 4206-75
Внешний вид: кристаллы рубиново-красного цвета
Фасовка: мешки, 25 кг
Условия хранения: в сухом, хорошо проветриваемом помещении
Молекулярный вес | 329.25 |
Растворимость в воде | 26, 8% (10ОС) |
Содержание основного вещества, не менее | 99,5 % (по факт.99,6 %) |
Нерастворимых в воде веществ,не более | 0,02 % (по факт.0,006 %) |
Содержание хлоридов, не более | 0,3 % (по факт.0,11 %) |
Содержание K4Fe(CN)6, не более | 0,4 % (по факт.0,14 %) |
(383) 289- 98- 09, (383) 289- 98- 08
(383) 279-97-52
(383) 279-98-76
Калий железосинеродистый (красная кровяная соль, феррицианид калия, калия гексацианоферриат) K3[Fe(CN)6] — тёмно-красные ромбические кристаллы; водный раствор жёлто-зеленоватой окраски; на свету постепенно разлагается с образованием K4[Fe(CN)6]. В щелочной среде железосинеродистый калий является сильным окислителем (особенно при нагревании). При нагревании с разбавленной серной кислотой разлагается с выделением синильной кислоты, при действии концентрированной h3SO4 выделяется окись углерода.
Получение
Получают Калий железосинеродистый ( калия гексацианоферрат) окислением K4[Fe(CN)6] хлором в солянокислой среде, бромом или другим сильным окислителем, например, перманганатом калия.
Применение
Калий железосинеродистый (красная кровяная соль, феррицианид калия, калия гексацианоферриат) используется
• в фотографии, как компонент тонирующих, отбеливающих, усиливающих, ослабляющих растворов в фотографии,
• как электролит в хемотронных приборах, компонент электролитов в гальванопластике, реагент для обнаружения Fe2+ , Li+ Sn2+, а также в качестве сильного окислителя,
• в почвоведении, для качественного определения оглеения (солей двухвалентного железа) и др.
www.shp-nsk.ru
Калий железосинеродистый — это… Что такое Калий железосинеродистый?
Жёлтая кровяная соль
Гексацианоферра́т(II) ка́лия (железистосинеро́дистый ка́лий, ферроциани́д ка́лия, гексацианоферриа́т ка́лия) — комплексное соединение двухвалентного железа K4[Fe(CN)6], существуюшее обычно в виде тригидрата K4[Fe(CN)6]·3H2O.
История открытия и тривиальные названия
- жёлтая кровяная соль — кристаллогидрат K4[Fe(CN)6]·3H2O.
- жёлтое синькали.
Тривиальное название появилось из-за того, что ранее «жёлтую кровяную соль» получали путем сплавления отходов с боен (в частности, крови) с поташом и железными опилками. Это, а также жёлтый цвет кристаллов, обусловили название соединения.
Получение
В настоящее время в промышленности получают из отработанной массы (содержит цианистые соединения) после очистки газов на газовых заводах; эту массу обрабатывают суспензией Ca(OH)2, фильтрат содержащий Ca2[Fe(CN)6], перерабатывают путём последовательного добавления сначала KCl, а затем K2CO3.
Он так же может быть получен путём взаимодействия суспензии FeS с водным раствором KCN. Реакцию можно представить следующей схемой:
1. цианид калия переводит Fe2+ в белый осадок гексацианоферрата(II) железа(II) (а не в цианид железа(II), как считалось ранее, что вытекает из взаимодействия этого цианида со щёлочью: 3Fe(CN)2 + 4KOH → 2Fe(OH)2↓ + K4[Fe(CN)6]):
3Fe2+ + 6CN— → Fe2[Fe(CN)6]↓
2. затем осадок растворяется в избытке KCN с образованием «жёлтой кровяной соли»:
Fe2[Fe(CN)6] + 12CN— → 3[Fe(CN)6]4-
Свойства
Светло-жёлтые кристаллы с тетрагональной решеткой, существующие в виде тригидрата K4[Fe(CN)6]·3Н2О.
Плотность 1,853 г/см³ при 17 °C. Растворимость в воде 31,5 г/100 г при 25 °C, 48,3 при 50 °C. Практически не растворяется в эфире, этаноле, пиридине, анилине, этилацетате.
Гексацианоферрат(II) калия диамагнитен.
Выше 87,3 °C (по другим данным, выше 120 °C) превращается в безводную соль с плотностью 1,935 г/см³. Выше 650 °C разлагается:
3K4[Fe(CN)6] →(t) Fe3C + 5C + 3N2↑ + 12KCN
В реакции с соляной кислотой выделяется белый осадок железистосинеродистой кислоты (H4[Fe(CN)6]).
С концентрированной серной кислотой реагирует по уравнению:
K4[Fe(CN)6] + 6H2SO4 →(t) 2K2SO4 + FeSO4 + 3(NH4)2SO4 + 6CO↑.
Этим способом можно пользоваться в лаборатории для получения монооксида углерода.
С солями металлов в степени окисления +2 и +3, образует малорастворимые соединения гексацианоферратов(II) (см. в разделе «применение»).
В водных растворах окисляется хлором и другими окислителями, такими, как перекись водорода до K3[Fe(CN)6]:
2K4[Fe(CN)6] + H2O2 + 2HCl → 2K3 [Fe(CN)6] + 2KCl + 2H2O
Анион [Fe(CN)6]4- очень прочен (константа образования 8·1036, не разлагается ни щелочами, ни кислотами, устойчив по отношению к воздуху; поэтому растворы ферроцианидов не показывают реакций ни на Fe2+, ни на CN—. Благодаря этому, «жёлтая кровяная соль», в отличие от красной, не ядовита.
Применение
Применяют при изготовлении пигментов, крашении шёлка, в производстве цианистых соединений, ферритов, цветной бумаги, как компонент ингибирующих покрытий и при цианировании сталей, для выделения и утилизации радиоактивного цезия.
Гексацианоферрат(II) калия применяется в аналитической химии как реактив для обнаружения некоторых катионов:
1. Fe3+: образуется малорастворимый синий осадок «берлинской лазури»:
FeIIICl3 + K4[FeII(CN)6] → KFeIII[FeII(CN)6] + 3KCl,
или, в ионной форме
Fe3+ + [Fe(CN)6]4- → [Fe2(CN)6]—
Получающийся гексацианоферрат(II) калия-железа(III) слабо растворим (с образованием коллоидного раствора), поэтому носит название «растворимая берлинская лазурь».
2. Zn2+: образуется белый осадок гексацианоферрата(II) цинка-калия:
3ZnCl2 + 2K4[FeII(CN)6] → K2Zn3[Fe(CN)6]↓ + 6KCl,
или, в ионной форме
3Zn2+ + 2K+ + 2[Fe(CN)6]4- → K2Zn3[Fe(CN)6]↓
3. Cu2+: из нейтральных или слабокислых растворов выпадает красно-бурый осадок гексацианоферрата(II) меди(II):
2CuCl2 + K4[FeII(CN)6] → Cu2[Fe(CN)6]↓ + 4KCl,
или, в ионной форме
2Cu2+ + [Fe(CN)6]4- → Cu2[Fe(CN)6]↓
Может использоваться для получения синильной кислоты:
K4Fe(CN)6 + 2H2SO4 → H4Fe(CN)6 + 2K2SO4
3H4Fe(CN)6 → Fe3C + 5C + 3N2 + 12HCN
В пищевой промышленности ферроцианид калия зарегистрирован в качестве пищевой добавки E536, препятствующей слёживанию и комкованию. Применяется как добавка к поваренной соли.
Мнемоническое правило
Для того, чтобы запомнить формулу желтой кровяной соли K4[Fe(CN)6] и не спутать ее с красной кровяной солью K3[Fe(CN)6], существует мнемоническое правило:
- Число атомов калия соответствует числу букв в английских названиях солей: «gold» — 4 буквы, то есть 4 атома калия — желтая кровяная соль K4[Fe(CN)6]. «Red» — три буквы, то есть три атома калия — красная кровяная соль — K3[Fe(CN)6].
См. также
Ссылки
Е-536 Ферроцианид калия как пищевая добавка
Wikimedia Foundation. 2010.
dic.academic.ru
Калий железосинеродистый Википедия
| Гексацианоферрат | |
|---|---|
 | |
| Систематическое наименование | Гексацианоферрат(III) калия |
| Традиционные названия | красная кровяная соль, красное синькали |
| Хим. формула | K3[Fe(CN)6] |
| Состояние | тёмно-красные (ярко-оранжевые) кристаллы |
| Молярная масса | 329,25 г/моль |
| Плотность | 1,845 г/см³ |
| Мол. теплоёмк. | 316,3 Дж/(моль·К) |
| Энтальпия образования | −173,2 кДж/моль |
| Растворимость в воде | 40,8 г/100 г (15,6 °C) |
| Рег. номер CAS | 13746-66-2 |
| PubChem | 26250 |
| Рег. номер EINECS | 237-323-3 |
| SMILES | |
| InChI | |
| RTECS | LJ8225000 |
| ChEBI | 30060 |
| ChemSpider | 19957218 |
| Приводятся данные для стандартных условий (25 °C, 100 кПа), если не указано иного. | |
Гексацианоферра́т(III) ка́лия (железосинеро́дистый ка́лий[1]) — неорганическое комплексное соединение трёхвалентного железа с химической формулой K3[Fe(CN)6].
Синонимы: феррициани́д ка́лия[2], гексацианоферриа́т ка́лия, соль Гмелина[3], красная кровяная соль[4].
История и происхождение названия
В 1822 году немецким химиком Леопольдом Гмелином соединение было приготовлено путём окисления «жёлтой кровяной соли». Этот факт, а также красный цвет кристаллов, обусловили происхождение традиционного названия «красная кровяная соль».
Свойства
Выглядит как тёмно-красные кристаллы с моноклинной решеткой, имеет плотность 1,845 г/моль, хорошо растворим в воде: 40,8 г/100 г (15,6 °C), 58,7 г/100 г (37,8 °C)[4]. Водный раствор зеленовато-жёлтого цвета. В этаноле нерастворим.
Гексацианоферрат(III) калия — очень сильный окислитель, особенно в щелочной среде. Окисляет сероводород до серы, иодоводород до иода, оксид свинца(II) до оксида свинца(IV), аммиак до азота и солей аммония, вольфрам до WO42−[4]:
- W+6K3[Fe(CN)6]+8KOH→ 6K4[Fe(CN)6]+K2WO4+4h3O{\displaystyle {\mathsf {W+6K_{3}[Fe(CN)_{6}]+8KOH{\xrightarrow {}}\ 6K_{4}[Fe(CN)_{6}]+K_{2}WO_{4}+4H_{2}O}}}
На свету происходят следующие обратимые реакции:
- K3[Fe(CN)6]+h3O⇄ K2[Fe(h3O)(CN)5]+KCN{\displaystyle {\mathsf {K_{3}[Fe(CN)_{6}]+H_{2}O\rightleftarrows \ K_{2}[Fe(H_{2}O)(CN)_{5}]+KCN}}}
- KCN+h3O⇄ HCN+KOH{\displaystyle {\mathsf {KCN+H_{2}O\rightleftarrows \ HCN+KOH}}}
С солями Fe2+ образует темно-синий осадок турнбулевой сини[4]. Уравнение реакции в ионной форме:
- 4Fe2++3[Fe(CN)6]3−→Fe4III[FeII(CN)6]3{\displaystyle {\mathsf {4Fe^{2+}+3[Fe(CN)_{6}]^{3-}\rightarrow Fe_{4}^{III}[Fe^{II}(CN)_{6}]_{3}}}}
Ранее считалось, что при этом образуется гексацианоферрат(III) железа(II), то есть FeII3[Fe(CN)6]2, именно такую формулу предлагали для «турнбулевой сини». Теперь известно, что турнбулева синь и берлинская лазурь — одно и то же вещество, а в процессе реакции происходит переход электронов от ионов Fe2+ к гексацианоферрат(III) — иону (валентная перестройка Fe2+ + [Fe3+(CN)6] к Fe3+ + [Fe2+(CN)6] происходит практически мгновенно, обратную реакцию можно осуществить в вакууме при 300 °C). Эта реакция является аналитической и используется для определения ионов Fe2+.Соли Fe3+ при этом не мешают, так как дают только слабое зеленовато-коричневое окрашивание (гексацианоферрат(III) железа(III) Fe3+[Fe3+(CN)6] устойчив только в растворах).
С концентрированной серной кислотой реагирует с образованием моноксида углерода[5]:
- 2K3[Fe(CN)6]+11h3SO4+13h3O→3K2SO4+6(Nh5)3SO4+2FeSO4+11CO↑+CO2↑{\displaystyle {\mathsf {2K_{3}[Fe(CN)_{6}]+11H_{2}SO_{4}+13H_{2}O\rightarrow 3K_{2}SO_{4}+6(NH_{4})_{3}SO_{4}+2FeSO_{4}+11CO{\uparrow }+CO_{2}{\uparrow }}}}
Реагирует с перекисью бария (эта реакция может использоваться для количественного определения BaO2):
- BaO2+2K3[Fe(CN)6]→ K6Ba[Fe(CN)6]2+O2↑{\displaystyle {\mathsf {BaO_{2}+2K_{3}[Fe(CN)_{6}]{\xrightarrow {}}\ K_{6}Ba[Fe(CN)_{6}]_{2}+O_{2}{\uparrow }}}}
При взаимодействии с кислотами выделяет весьма токсичный цианистый водород[5]:
- K3[Fe(CN)6]+6HCl→ 3KCl+FeCl3+6HCN↑{\displaystyle {\mathsf {K_{3}[Fe(CN)_{6}]+6HCl{\xrightarrow {}}\ 3KCl+FeCl_{3}+6HCN{\uparrow }}}}
Интересно то, что из гексацианоферрата(III) калия можно получить гексацианоферрат(II) калия с помощью перекиси водорода в щелочной среде:
- 2K3[Fe(CN)6]+h3O2+2KOH→ 2K4[Fe(CN)6]+2h3O+O2↑{\displaystyle {\mathsf {2K_{3}[Fe(CN)_{6}]+H_{2}O_{2}+2KOH{\xrightarrow {}}\ 2K_{4}[Fe(CN)_{6}]+2H_{2}O+O_{2}{\uparrow }}}}
Однако в нейтральной среде эта реакция протекает в обратную сторону.
Получение
Получают гексацианоферрат(III) калия окислением гексацианоферрата(II) калия K4[Fe(CN)6] хлором в солянокислой среде, бромом или другими сильными окислителями, например, перманганатом калия.
Применение
Компонент тонирующих, отбеливающих, усиливающих, ослабляющих растворов в фотографии, электролит в хемотронных приборах, компонент электролитов в гальванопластике, реагент для обнаружения Fe2+ (см. выше), Li+, Sn2+, а также в качестве сильного окислителя.
В почвоведении используют для качественного определения оглеения (солей двухвалентного железа). Химическая реакция описана выше.
Безопасность
Это вещество может раздражать глаза и кожу, является токсичным[4][6]. В кислой среде может выделяться циановодород и угарный газ. Например, в случае концентрированной серной кислоты разложение идет с образованием монооксида углерода[5]:
- 2K3[Fe(CN)6]+11h3SO4+13h3O→3K2SO4+6(Nh5)3SO4+2FeSO4+11CO↑+CO2↑{\displaystyle {\mathsf {2K_{3}[Fe(CN)_{6}]+11H_{2}SO_{4}+13H_{2}O\rightarrow 3K_{2}SO_{4}+6(NH_{4})_{3}SO_{4}+2FeSO_{4}+11CO{\uparrow }+CO_{2}{\uparrow }}}}
Но в разбавленной серной кислоте, при падении концентрации ниже 80 %, доминирующей становится реакция с образованием циановодорода[5]:
- 2K3[Fe(CN)6]+6h3SO4→3K2SO4+Fe2(SO4)3+12HCN↑{\displaystyle {\mathsf {2K_{3}[Fe(CN)_{6}]+6H_{2}SO_{4}\rightarrow 3K_{2}SO_{4}+Fe_{2}(SO_{4})_{3}+12HCN{\uparrow }}}}
Мнемонические правила
Для того, чтобы запомнить формулу красной кровяной соли K3[Fe(CN)6] и не перепутать её с формулой желтой кровяной соли K4[Fe(CN)6], существует несколько мнемонических правил:
- В соли красной кровяной калий с тройкой за стеной. Дальше — феррум, шесть цианов: все готово без обманов.
- Число атомов калия соответствует числу букв в английских названиях солей: «gold» — 4 буквы, то есть 4 атома калия — желтая кровяная соль K4[Fe(CN)6]. «Red» — три буквы, то есть три атома калия — красная кровяная соль — K3[Fe(CN)6].
- «Калий три — будет красный». Мнемоника построена на игре слов: «три» (число) и «три» (повелительное наклонение глагола «тереть»). Как известно при потирании, например, кожи, последняя краснеет.
См. также
Примечания
Литература
wikiredia.ru
ГОСТ 4206-75 Калий железосинеродистый. Технические условия (с Изменением N 1), ГОСТ от 05 февраля 1975 года №4206-75
ГОСТ 4206-75
Группа Л51
ОКП 26 2113 0340 08
Срок действия с 01.01.76
до 01.01.96*
_______________________________
* Ограничение срока действия снято
по протоколу N 5-94 Межгосударственного
Совета по стандартизации, метрологии
и сертификации (ИУС 11/12 1994 год). —
Примечание изготовителя базы данных.
1. РАЗРАБОТАН И ВНЕСЕН Министерством химической промышленности СССР
РАЗРАБОТЧИКИ:
Г.В.Грязнов, В.Г.Брудзь, И.Л.Ротенберг, В.Н.Смородинская, К.П.Лесина, Л.В.Кидиярова, И.В.Жарова
2. УТВЕРЖДЕН И ВВЕДЕН В ДЕЙСТВИЕ Постановлением Государственного комитета стандартов Совета Министров СССР от 05.02.75 N 324
3. В стандарт введен МС ИСО 6353/3-87 (Р.81) в части квалификации х.ч.
4. ВЗАМЕН ГОСТ 4206-65
5. ССЫЛОЧНЫЕ НОРМАТИВНО-ТЕХНИЧЕСКИЕ ДОКУМЕНТЫ
Обозначение НТД, на который дана ссылка | Номер пункта, подпункта |
ГОСТ 12.1.005-88 | 6.1 |
ГОСТ 12.1.007-76 | 6.1 |
ГОСТ 1770-74 | 3.2.1, 3.3.1, 3.6.1 |
ГОСТ 3118-77 | 3.2.1 |
ГОСТ 3885-73 | 2.1, 3.1, 4.1 |
ГОСТ 4165-78 | 3.5 |
ГОСТ 4174-77 | 3.2.1 |
ГОСТ 4204-77 | 3.6.1 |
ГОСТ 4232-74 | 3.2.1 |
ГОСТ 4517-87 | 3.2,1, 3.6.1 |
ГОСТ 4919.1-77 | 3.2.1 |
ГОСТ 6709-72 | 3.2.1, 3.3.1 |
ГОСТ 10163-76 | 3.2.1 |
ГОСТ 10671.5-74 | 3.4 |
ГОСТ 10671.7-74 | 3.5 |
ГОСТ 20292-74* | 3.2.1, 3.6.1 |
ГОСТ 20490-75 | 3.6.1 |
ГОСТ 25336-82 | 3.2.1, 3.3.1, 3.6.1 |
ГОСТ 25794.2-83 | 3.2.1, 3.6.1 |
ГОСТ 27025-86 | 3.1а |
ГОСТ 27068-86 | 3.2.1 |
________________
* На территории Российской Федерации действуют ГОСТ 29169-91, ГОСТ 29227-91-ГОСТ 29229-91, ГОСТ 29251-91-ГОСТ 29253-91. Здесь и далее по тексту. — Примечание изготовителя базы данных.
6. Срок действия продлен до 01.01.96 Постановлением Госстандарта СССР от 14.03.90 N 424.
7. ПЕРЕИЗДАНИЕ (декабрь 1992 г.) с Изменением N 1, утвержденным в марте 1990 г. (ИУС 6-90)
Настоящий стандарт распространяется на железосинеродистый калий (гексацианоферрат (III) калия), представляющий собой кристаллы рубиново-красного цвета; растворим в воде.
Формула K[Fe(CN)].
Молекулярная масса (по международным атомным массам 1971 г.) — 329,26.
(Измененная редакция, Изм. N 1).
1. ТЕХНИЧЕСКИЕ ТРЕБОВАНИЯ
1.1а. Железосинеродистый калий должен быть изготовлен в соответствии с требованиями настоящего стандарта по технологическому регламенту, утвержденному в установленном порядке.
(Введен дополнительно, Изм. N 1).
1.1. По химическим показателям железосинеродистый калий должен соответствовать нормам, указанным в таблице.
Наименование показателя | Норма | ||
Химически чистый (х.ч.) | Чистый для анализа (ч.д.а.) ОКП | Чистый (ч.) | |
1. Массовая доля железосинеродистого калия K[Fe(CN)], %, не менее | 99,5 | 99,0 | 99,0 |
2. Массовая доля не растворимых в воде веществ, %, не более | 0,005 | 0,01 | 0,02 |
3. Массовая доля сульфатов (SO), %, не более | 0,005 | 0,01 | 0,02 |
4. Массовая доля хлоридов (Сl), %, не более | 0,005 | 0,01 | 0,04 |
5. Массовая доля железистосинеродистой соли [Fe(CN)], %, не более | 0,025 | 0,05 | 0,10 |
2. ПРАВИЛА ПРИЕМКИ
2.1. Правила приемки — по ГОСТ 3885-73.
3. МЕТОДЫ АНАЛИЗА
3.1а. Общие указания по проведению анализа — по ГОСТ 27025-86.
При взвешивании применяют лабораторные весы общего назначения типов ВЛР-200г и ВЛКТ-500г-М или ВЛЭ-200 г.
Допускается применение других средств измерения с метрологическими характеристиками и оборудования с техническими характеристиками не хуже, а также реактивов по качеству не ниже указанных в настоящем стандарте.
(Введен дополнительно, Изм. N 1).
3.1. Пробы отбирают по ГОСТ 3885-73. Масса средней пробы должна быть не менее 125 г.
3.2. Определение массовой доли железосинеродистого калия
3.2.1. Аппаратура, реактивы и растворы:
бюретка 1(2)-2-50-0,1 по ГОСТ 20292-74;
колба Кн-1- 500-29/32 (34/35) ТС по ГОСТ 25336-82;
пипетка 6(7)-2-5(10) по ГОСТ 20292-74;
цилиндр 1(3)-50(100) по ГОСТ 1770-74;
вода дистиллированная по ГОСТ 6709-72;
калий йодистый по ГОСТ 4232-74, х.ч.;
крахмал растворимый по ГОСТ 10163-76, раствор с массовой долей 0,5%; готовят по ГОСТ 4919.1-77;
кислота соляная по ГОСТ 3118-77, раствор с массовой долей 10%; готовят по ГОСТ 4517-87;
натрий серноватистокислый (натрия тиосульфат) 5-водный по ГОСТ 27068-86; раствор концентрации (NaSO·5HO)=0,1 моль/дм; готовят по ГОСТ 25794.2-83;
цинк сернокислый 7-водный по ГОСТ 4174-77.
3.2.2. Проведение анализа
Около 0,7000 г препарата помещают в коническую колбу с пришлифованной пробкой, растворяют в 50 см воды, прибавляют 1,5 г йодистого калия и 5 см раствора соляной кислоты. Перемешивают и оставляют в покое на 1 мин. Затем прибавляют 3 г 7-водного сернокислого цинка, растворенного в 10 см воды, закрывают колбу пробкой и перемешивают. Через 1 мин обмывают пробку небольшим количеством воды и титруют из бюретки выделившийся йод раствором 5-водного серноватистокислого натрия, прибавляя в конце титрования 1-2 см раствора крахмала.
3.2.3. Обработка результатов
Массовую долю железосинеродистого калия () в процентах вычисляют по формуле
,
где — объем раствора 5-водного серноватистокислого натрия концентрации точно 0,1 моль/дм, израсходованный на титрование, см;
— масса навески препарата, г;
0,03293 — масса железосинеродистого калия, соответствующая 1 см раствора 5-водного серноватистокислого натрия концентрации точно 0,1 моль/дм, г.
За результат анализа принимают среднее арифметическое результатов двух параллельных определений, абсолютное расхождение между которыми не превышает допускаемое расхождение, равное 0,25%.
Допускаемая абсолютная суммарная погрешность результатов анализа ±0,5% при доверительной вероятности 0,95
.
3.3. Определение массовой доли нерастворимых в воде веществ
3.3.1. Растворы и посуда:
вода дистиллированная по ГОСТ 6709-72;
стакан В (Н)-1-400 по ГОСТ 25336-82;
цилиндр 1(3)-250 или мензурка 250 по ГОСТ 1770-74;
тигель фильтрующий по ГОСТ 25336-82 типа ТФ ПОР10 или ПОР16.
3.3.2. Проведение анализа
20,00 г препарата помещают в стакан и растворяют в 200 см воды. Стакан накрывают часовым стеклом и выдерживают на водяной бане в течение 1 ч. Затем раствор фильтруют через фильтрующий тигель, предварительно высушенный до постоянной массы и взвешенный. Результат взвешивания в граммах записывают до четвертого десятичного знака. Остаток на фильтре промывают 50 см горячей воды и сушат в сушильном шкафу при 105-110 °С до постоянной массы.
Препарат считают соответствующим требованиям настоящего стандарта, если масса остатка после высушивания не будет превышать:
для препарата «химически чистый» — 1 мг,
для препарата «чистый для анализа» — 2 мг,
для препарата «чистый» — 4 мг.
Допускаемая относительная суммарная погрешность результата анализа ±40% для препарата квалификации «химически чистый» и «чистый для анализа» и ±20% для препарата «чистый» при доверительной вероятности 0,95.
3.4. Определение массовой доли сульфатов
Определение проводят по ГОСТ 10671.5-74. При этом 1,00 г препарата помещают в коническую колбу вместимостью 100 см и растворяют в 46 см воды. Если раствор мутный, то его фильтруют через трижды промытый горячей водой обеззоленный фильтр «синяя лента». Далее определение проводят визуально-нефелометрическим методом (способ 3).
Препарат считают соответствующим требованиям настоящего стандарта, если наблюдаемая на темном фоне через 15 мин опалесценция анализируемого раствора не будет интенсивнее опалесценции раствора, приготовленного одновременно с анализируемым и содержащего в таком же объеме:
для препарата «химически чистый» — 0,05 мг SO,
для препарата «чистый для анализа» — 0,10 мг SO,
для препарата «чистый» — 0,20 мг SO,
10 см раствора препарата, не содержащего сульфатов (соответствуют 1 г препарата), 1 см раствора соляной кислоты и 3 см раствора хлористого бария.
Раствор препарата, не содержащий SO, готовят следующим образом: 5,00 г железосинеродистого калия помещают в коническую колбу вместимостью 100 см (с меткой на 50 см), растворяют в 20 см воды, прибавляют 2 см раствора хлористого бария, доводят объем раствора водой до метки и перемешивают. Раствор выдерживают в течение 24 ч, затем фильтруют через трижды промытый горячей водой обеззоленный фильтр «синяя л
ента».
3.5. Определение массовой доли хлоридов
Определение проводят по ГОСТ 10671.7-74. При этом 1,00 г препарата помещают в стакан вместимостью 250 см, растворяют в 85 см воды, прибавляют 15 см раствора 5-водной сернокислой меди (ГОСТ 4165-78, х.ч.) с массовой долей 12,5%, перемешивают и оставляют в покое на 1 ч. Затем раствор фильтруют через обеззоленный фильтр «синяя лента», промытый горячим раствором азотной кислоты с массовой долей 1%, отбрасывая первую порцию фильтрата.
20 см фильтрата (соответствуют 0,2 г препарата) переносят пипеткой в коническую колбу вместимостью 50 см, прибавляют 20 см воды. Далее определение проводят визуально-нефелометрическим методом (способ 2).
Препарат считают соответствующим требованиям настоящего стандарта, если масса хлоридов не будет более:
для препарата «химически чистый» — 0,010 мг,
для препарата «чистый для анализа» — 0,020 мг,
для препарата «чистый» — 0,080 мг.
При необходимости в результат определения вносят поправку на массу хлоридов в применяемом количестве 5-водной сернокислой меди.
3.6. Определение массовой доли железистосинеродистой соли
3.6.1. Аппаратура, реактивы и растворы:
бюретка 6-2-1(2) или 7-2-3 по ГОСТ 20292-74;
колба Кн-2-1000-42 ТХС по ГОСТ 25336-82;
цилиндр 1-1000 по ГОСТ 1770-74;
вода дистиллированная, не содержащая кислорода; готовят по ГОСТ 4517-87;
кислота серная по ГОСТ 4204-77, раствор с массовой долей 20%; готовят по ГОСТ 4517-87;
калий марганцовокислый по ГОСТ 20490-75, раствор концентрации (1/5 KMnO)=0,05 моль/дм; готовят по ГОСТ 25794.2-83.
3.6.2. Проведение анализа
8,00 г препарата помещают в коническую колбу и растворяют в 800 см воды.
Раствор делят на две равные части, к одной из них прибавляют 10 см раствора серной кислоты и титруют из бюретки раствором марганцовокислого калия до появления красноватой окраски при сравнении с контрольной пробой (вторая часть раствора).
Препарат считают соответствующим требованиям настоящего стандарта, если на титрование будет израсходовано раствора марганцовокислого калия:
для препарата «химически чистый» — не более 0,1 см,
для препарата «чистый для анализа» — не более 0,2 см,
для препарата «чистый» — не более 0,4 см.
Разд.3. (Измененная редакция, Изм. N 1).
4. УПАКОВКА, МАРКИРОВКА, ТРАНСПОРТИРОВАНИЕ И ХРАНЕНИЕ
4.1. Препарат упаковывают и маркируют в соответствии с ГОСТ 3885-73.
Вид и тип тары: 2т-1, 2т-2, 2т-4, 6-2, 2-9, обернутые в светонепроницаемую бумагу;
Группа фасовки: IV, V, VI не более 3 кг.
(Измененная редакция, Изм. N 1).
4.2. Препарат перевозят всеми видами транспорта в соответствии с правилами перевозки грузов, действующими на данном виде транспорта.
4.3. Препарат хранят в упаковке изготовления в крытых складских помещениях.
5. ГАРАНТИИ ИЗГОТОВИТЕЛЯ
5.3. Изготовитель гарантирует соответствие железосинеродистого калия требованиям настоящего стандарта при соблюдении условий транспортирования и хранения.
5.2. Гарантийный срок хранения препарата — два года со дня изготовления.
Разд.5 (Измененная редакция, Изм. N 1).
6. ТРЕБОВАНИЯ БЕЗОПАСНОСТИ
6.1. В обычных условиях железосинеродистый калий не ядовит, но в присутствии свободных кислот или кислых солей, в особенности при нагревании до 40-50 °С, разлагается с выделением синильной кислоты — сильного яда. При попадании в организм человека, под действием кислоты желудочного сока, образуется синильная кислота, вызывающая отравление.
Раствор железосинеродистого калия обладает раздражающим действием на кожу.
Предельно допустимая концентрация в воздухе рабочей зоны 4 мг/м по ГОСТ 12.1.005-88, класс опасности III (умеренно опасные вещества) по ГОСТ 12.1.007-76.
(Измененная редакция, Изм. N 1).
6.2. При работе с препаратом необходимо пользоваться индивидуальными средствами защиты (респиратор, резиновые перчатки и защитные очки), а также соблюдать меры личной гигиены. Не допускать попадания препарата внутрь организма.
6.3. Все рабочие помещения должны быть оборудованы общей приточно-вытяжной вентиляцией; испытание препарата в лаборатории следует проводить в вытяжном шкафу. В местах наибольшего пыления продукта должны быть предусмотрены местные отсосы.
(Измененная редакция, Изм. N 1).
Электронный текст документа
подготовлен АО «Кодекс» и сверен по:
официальное издание
М.: Издательство стандартов, 1993
docs.cntd.ru
