ГОСТ 30813-2002 Вода и водоподготовка. Термины и определения
Информация Скан-копия Текст документа Отзывы (0)
2.1. Термины и определения
ГОСТ 30813-2002
МЕЖГОСУДАРСТВЕННЫЙ СТАНДАРТ
ВОДА И ВОДОПОДГОТОВКА
Термины и определения
МЕЖГОСУДАРСТВЕННЫЙ СОВЕТ
ПО СТАНДАРТИЗАЦИИ, МЕТРОЛОГИИ И СЕРТИФИКАЦИИ
Минск
Предисловие
1 РАЗРАБОТАН Техническим комитетом по стандартизации ТК 343 «Качество воды» (ВНИИстандарт, Научно-исследовательский институт экологии человека и гигиены окружающей среды им. А.Н. Сысина, Федеральный центр Госсанэпиднадзора России, АЦ «Роса», ГУП «Центр исследования и контроля воды», ООО «Люмэкс», Научно-исследовательский институт коммунального водоснабжения и очистки воды, Нижегородский центр стандартизации, метрологии и сертификации, ГФУП Всероссийский научно-исследовательский институт гидрогеологии и инженерной геологии, Федеральный научный центр гигиены им.
ВНЕСЕН Госстандартом России
2 ПРИНЯТ Межгосударственным Советом по стандартизации, метрологии и сертификации (протокол № 21 от 30 мая 2002 г.)
За принятие проголосовали:
Наименование государства | Наименование национального органа по стандартизации |
Республика Армения | Армгосстандарт |
Республика Казахстан | Госстандарт Республики Казахстан |
Кыргызская Республика | Кыргызстандарт |
Республика Молдова | Молдовастандарт |
Российская Федерация | Госстандарт России |
| Республика Таджикистан | Таджикстандарт |
Туркменистан | Главгосслужба «Туркменстандартлары» |
Республика Узбекистан | Узгосстандарт |
3 Настоящий стандарт содержит термины, предусмотренные в ИСО 6107-1-8:1996 «Качество воды. Словарь», с уточнениями и дополнениями, отражающими практику в области водоподготовки
Словарь», с уточнениями и дополнениями, отражающими практику в области водоподготовки
4 Постановлением Государственного комитета по стандартизации и метрологии от 12 ноября 2002 г. № 409-ст межгосударственный стандарт ГОСТ 30813-2002 введен в действие непосредственно в качестве государственного стандарта Российской Федерации с 1 января 2004 г.
5 ВВЕДЕН ВПЕРВЫЕ
СОДЕРЖАНИЕ
Введение
Установленные в стандарте термины расположены в систематизированном порядке, отражающем систему понятий в области водных объектов, отбора проб, водоподготовки, оборудования и материалов для водоподготовки, систем питьевого водоснабжения, а также физико-химических и биологических показателей качества воды.
Для каждого понятия установлен один стандартизованный термин.
Приведенные определения можно, при необходимости, изменить, вводя в них производные признаки, раскрывая значения используемых в них терминов, указывая объекты, входящие в объем определяемого понятия. Изменения не должны нарушать объем и содержание понятий, определенных в данном стандарте.
Изменения не должны нарушать объем и содержание понятий, определенных в данном стандарте.
В стандарте приведены иноязычные эквиваленты стандартизованных терминов на немецком (de), английском (en) и французском (fr) языках.
Термины и определения понятий, необходимые для понимания текста стандарта, приведены в приложении А.
Стандартизованные термины набраны полужирным шрифтом, их краткие формы, в том числе аббревиатуры, — светлым.
В тексте стандарта отдельные термины помечены знаками *, **:
* — термин введен дополнительно к ИСО 6107-1-8:1996;
** — термин и (или) его определение уточнены по отношению к приведенным в ИСО 6107-1-8:1996.
ГОСТ 30813-2002
МЕЖГОСУДАРСТВЕННЫЙ СТАНДАРТ
ВОДА И ВОДОПОДГОТОВКА Термины и определения Water and water-preparation. |
Дата введения 2004-01-01
Настоящий стандарт устанавливает основные термины и определения понятий в области водных объектов, водоподготовки, гидротехники, водоснабжения, канализации, а также показателей качества воды.
Термины, установленные настоящим стандартом, обязательны для применения во всех видах документации и литературы, входящих в сферу работ по стандартизации и/или использующих результаты этих работ.
Настоящий стандарт следует применять совместно со стандартами: ГОСТ 17.1.1.01; ГОСТ 19179; ГОСТ 19185; ГОСТ 25150; ГОСТ 25151; ГОСТ 26966; ГОСТ 27065.
В настоящем стандарте использованы ссылки на следующие стандарты:
ГОСТ 17.1.1.01-77 Охрана природы. Гидросфера. Использование и охрана вод. Основные термины и определения
ГОСТ 19179-73 Гидрология суши. Термины и определения
ГОСТ 19185-73 Гидротехника. Основные понятия. Термины и определения
ГОСТ 25150-82 Канализация. Термины и определения
ГОСТ 25151-82 Водоснабжение. Термины и определения
ГОСТ 26966-86 Сооружения водозаборные, водосбросные и затворы. Термины и определения
ГОСТ 27065-86 Качество вод. Термины и определения
ОБЩИЕ ПОНЯТИЯ | ||
1* питьевое водоснабжение: Деятельность, направленная на обеспечение потребителей питьевой водой, включающая в себя выбор, охрану источников и сооружений водоснабжения, проектирование, строительство, эксплуатацию систем водоснабжения, забор, подготовку, хранение, подачу к местам потребления и реализацию питьевой воды | en drinking water supply | |
2* гигиенические нормативы качества питьевой воды: Совокупность научно обоснованных и установленных санитарными правилами предельно допустимых значений показателей органолептических свойств, содержания химических веществ и микроорганизмов в питьевой воде, гарантирующих безопасность и безвредность питьевой воды для жизни и здоровья человека независимо от продолжительности ее использования | ||
3** питьевая вода: Вода, по качеству в естественном состоянии или после подготовки отвечающая гигиеническим нормативам и предназначенная для удовлетворения питьевых и бытовых потребностей человека либо для производства продукции, потребляемой человеком | de trinkbares Wasser en drinking water fr eau de boisson | |
4** минеральная вода: Природная подземная вода, характеризующаяся постоянным ионно-солевым составом, содержанием биологически активных компонентов и специфическими свойствами. Примечание — Минеральные воды чаще всего обладают повышенным солесодержанием и могут обладать лечебным действием | de Mineralwasser en mineral water fr eau minerale | |
5* подземная вода: Вода, в том числе минеральная, находящаяся в подземных водных объектах | ||
6* артезианская вода: Напорная подземная вода, заключенная в глубоких водоносных пластах между водонепроницаемыми слоями | ||
7* морская вода: Вода, сосредоточенная в морях и океанах | ||
8 дождевая вода: Вода, образованная из атмосферных осадков, в которую еще не поступили растворимые вещества из поверхностного слоя земли | de Regenwasser en rain water fr eau de pluie | |
ВОДНЫЕ ОБЪЕКТЫ | ||
9* источник питьевого водоснабжения: Водный объект (или его часть), который содержит воду, отвечающую установленным гигиеническим нормативам для источников питьевого водоснабжения, и используется или может быть использован для забора воды в системы питьевого водоснабжения | ||
10 родник: Естественный сосредоточенный выход подземной воды на поверхность земли | de Quelle en spring fr source | |
11 ручей: Небольшой водоток, образованный снеговыми, дождевыми водами, а также выходящими на поверхность подземными водами | de Bach en stream fr cours d’eau | |
12** море: Крупный естественный водоем, являющийся частью океана, обособленный сущей или возвышениями подводного рельефа и отличающийся от океана физико-географическими особенностями | de Meer en sea fr mer | |
13** стратификация водного объекта: Наличие внутри водной массы слоев, характеризующихся разной плотностью, температурой, солесодержанием, а также разным содержанием кислорода или биогенных элементов | de Schichtung en stratification fr stratification | |
14** дестратификация водного объекта: Перемешивание слоев воды в водоеме или резервуаре, приводящее к устранению стратификации | de Destratifizierung en destratification fr destratification | |
15* трофность водного объекта: Характеристика продукционных свойств водного объекта. Примечание — В порядке увеличения продукционных свойств выделяют три типа водных объектов: олиго-, мезо- и евтрофные | de troph en trophic fr trophe | |
ВОДОПОДГОТОВКА | ||
16** фильтрование воды: Отделение примесей, частей или микроорганизмов от воды через слой пористого материала или сетку | de Filtration en filtration fr filtration | |
17** мембранное фильтрование воды: Фильтрование воды через мембранный фильтр | de Membranfiltration en membrane filtration fr filtration sur membrane | |
18 дистилляция воды: Процесс выпаривания и конденсации, используемый для получения воды высокой степени чистоты | de Destillation en distillation fr distillation | |
19 деионизация воды: Уменьшение содержания ионов в воде | de Entionisierung en deionization fr deionisation | |
20 хлорирование воды: Обеззараживание воды путем добавления в воду хлора или его соединений, образующих хлорноватистую кислоту или гипохлорит-ионы | de Chlorung en chlorination fr chloration | |
21** гиперхлорирование воды: Хлорирование воды повышенными дозами хлора | de Stobchlorung en superchlorination fr surchloration | |
22 дехлорирование воды: Уменьшение содержания остаточного хлора в воде | de Entchlorung en dechlorination fr dechloration | |
23** аммонизация воды: Процесс добавления аммиака при водоподготовке | de Aminierung en ammonization fr ammoniation | |
24 озонирование воды: Использование озона в процессе водоподготовки для обеззараживания воды и улучшения ее органолептических свойств | de Ozonisierung en ozonization fr ozonisation | |
ОБОРУДОВАНИЕ И МАТЕРИАЛЫ ДЛЯ ВОДОПОДГОТОВКИ | ||
25** флокулянт: Вещество, вызывающее интенсивное образование рыхлых хлопьевидных агрегатов в результате агломерации находящихся в воде мелких взвешенных частиц | de Flockungshilfsmittel en flocculation aid fr adjuvant de floculation | |
26 ионообменный материал: Материал, способный к осуществлению обратимого обмена ионов между собой и контактирующей водой | de Ionenaustauschmaterial en ion-exchange material fr matiere echangeuse d’ions | |
27 зооглейная пленка: Клейкая биологическая пленка, содержащая бактерии рода Zoogloea, простейшие и грибы, покрывающая поверхности эксплуатируемых песчаных и биологических фильтров или внутренние поверхности канализационных труб | de Zoogloenfilm en zoogloeal film fr film de zooglee | |
28* водоочистные устройства: Технические изделия, предназначенные для очистки, доочистки, обеззараживания воды с целью улучшить ее качество для питьевых и бытовых нужд человека | ||
29* бытовые водоочистные устройства: Водоочистные устройства, эксплуатируемые и обслуживаемые самими потребителями | ||
СИСТЕМЫ ПИТЬЕВОГО ВОДОСНАБЖЕНИЯ | ||
30* централизованная система питьевого водоснабжения: Комплекс устройств, сооружений и трубопроводов, предназначенных для забора, подготовки или без нее, хранения, подачи к местам потребления питьевой воды и открытый для общего пользования | en centralization system of drinking water supply | |
31* нецентрализованная система питьевого водоснабжения: Устройства и сооружения, предназначенные для забора питьевой воды без подачи ее к местам потребления и открытые для общего пользования | en decentralization system of drinking water supply | |
32* автономная система питьевого водоснабжения: Устройства и сооружения, предназначенные для забора, подготовки или без подготовки питьевой воды, с подачей или без подачи ее к местам потребления, находящиеся в пользовании физических лиц и закрытые для общего пользования | ||
ОТБОР ПРОБ | ||
33** проба воды: Определенный объем воды, отобранный для исследования ее состава и свойств | de Probe en sample fr echantillon | |
34** точечная проба воды: Проба воды, получаемая однократным отбором необходимого объема воды в точке отбора проб | de Stichprobe en spot sample fr echantillon ponctuel | |
35** составная проба воды: Две или более проб воды или их частей, смешиваемых в заданных пропорциях | de Mischprobe en composite sample fr echantillon composite | |
36 автоматический отбор проб воды: Отбор проб воды без участия человека по разработанной программе | de automatische Probenahme en automatic sampling fr echantillonnage automatique | |
37 точка отбора пробы воды: Зафиксированное местоположение отбора пробы воды | de Probenahmestelle en sampling point fr point d’echantillonnage | |
38** сеть пунктов отбора проб воды: Совокупность заранее определенных точек отбора проб | de Probenahmenetz en sampling network fr reseau d’echantillonnage | |
39 пробоотборник: Устройство, используемое для отбора проб воды | de Probenehmer en sampler fr echantillonneur | |
40 консервация пробы воды: Добавление химического вещества и (или) изменение физических условий для уменьшения возможных искажений определяемых показателей в период между моментом отбора пробы воды и ее исследованием | de Probenstabilisierung en sample stabilization fr stabilisation de l’echantillon | |
ФИЗИКО-ХИМИЧЕСКИЕ ПОКАЗАТЕЛИ КАЧЕСТВА ВОДЫ | ||
41 взвешенные вещества в воде: Вещества, выделенные из воды путем фильтрования и (или) центрифугирования | de suspendierte Feststoffe en suspended solids fr matieres en suspension | |
42 общее содержание примесей в воде: Общее количество растворенных и взвешенных веществ в воде | de gesamter Feststoffgehalt en total solids fr matieres solides totales | |
43** удельная электропроводность воды: Электропроводность единицы объема воды | de elektrische Leitfahigkeit en electrical conductivity fr conductivite electrique | |
44 азот по Кьельдалю: Суммарная массовая концентрация органического и аммонийного азота в пробе воды, определяемая после воздействия на пробу серной кислотой при заданных условиях | de Kjeldahl-Stickstoff en Kjeldahl nitrogen fr azote Kjeldahl | |
45 перманганатная окисляемость: Химическое потребление кислорода при обработке пробы воды перманганатным ионом при определенных условиях | de Permanganat-Index (von Wasser) en permanganate index (of water) fr indice permanganate (de l’eau) | |
46* бихроматная окисляемость: Химическое потребление кислорода при обработке пробы воды бихроматным ионом при определенных условиях | ||
47 порог восприятия запаха воды: Минимальный уровень запаха воды, различимый ольфакторными органами человека Примечания 1 Абсолютного значения порога восприятия запахов не существует из-за врожденной разницы ольфакторной чувствительности у разных людей. 2 Значение порога восприятия запаха воды определяют серийным разведением пробы воды чистой водой без запаха до тех пор, пока запах не станет неразличим | de Geruchsschwelle en odour threshold fr seuil olfactif | |
48 остаточной хлор: Хлор, остающийся в воде после хлорирования в виде свободного или связанного хлора или в обоих видах сразу | de gesamtes Restchlor en residual chlorine fr chlore residuel | |
49** свободный хлор: Хлор, присутствующий в воде в виде хлорноватистой кислоты или (и) гипохлорит-иона | de freies Chlor en free chlorine fr chlore libre | |
50* связанный хлор: Хлор, присутствующий в воде в виде хлораминов | ||
51* фенольный индекс: Массовая концентрация фенолов в воде, вступающих в реакцию с 4-аминоантипирином и в определенных условиях образующих с ним окрашенные соединения | ||
52* содержание нефтепродуктов в воде: Экстрагируемые из воды неполярные и малополярные углеводороды. Примечание — В международной практике используют термин «углеводородный индекс» | en hydrocarbon oil index | |
БИОЛОГИЧЕСКИЕ ПОКАЗАТЕЛИ КАЧЕСТВА ВОДЫ | ||
53** донные отложения: Донные наносы и твердые частицы, образовавшиеся и осевшие на дно водного объекта в результате внутриводоемных физико-химических и биохимических процессов, происходящих с веществами как естественного, так и техногенного происхождения | ||
54 планктон: Сообщество организмов, состоящее из растений и животных, взвешенных в толще воды и дрейфующих с ее потоками | de Plankton en plankton fr plancton | |
55 фитопланктон: Часть планктона, представленная растениями | de Phytoplankton en phytoplankton fr phytoplancton | |
56 зоопланктон: Часть планктона, представленная животными | de Zooplankton en zooplankton fr zooplancton | |
57 макрофиты: Высшие водные растения | de Makrophyten en macrophytes fr macrophytes | |
58** водоросли: Группа одно- или многоклеточных низших водных растений, включая цианобактерии | de Algen en algae fr algues | |
59* водные сапрофитные микроорганизмы: Гетеротрофные микроорганизмы, использующие для питания органические вещества, в том числе продукты жизнедеятельности и останки организмов | de wasser saprophitare Mikroorganismus en water saprophyte microorganisms | |
60** общее микробное число; ОМЧ: Общее число мезофильных аэробных и факультативно анаэробных микроорганизмов, способных образовывать колонии на питательном агаре при температуре 37 °С в течение 24 ч, видимые с увеличением в два раза. Примечание — Наряду с инкубацией при температуре 37 °С используют инкубацию посевов при температуре 20-22 °С в течение 72 ч для учета сапрофитных водных микроорганизмов | de Koloniezahl en Plate count fr numeration sur plaque | |
61* индикаторные микроорганизмы: Условные группы микроорганизмов, присутствие которых свидетельствует о наличии антропогенного загрязнения и (или) недостаточной очистке воды | de Indikator-mikroorganismus en indicating microorganisms | |
62* санитарно-показательные микроорганизмы: Индикаторные микроорганизмы, свидетельствующие о возможном фекальном загрязнении и потенциальной опасности присутствия в воде возбудителей инфекционных заболеваний | de hygienisches indikator Mikroorganismus en sanitary-indicatory microorganisms | |
63** общие колиформные бактерии; общие колиформы: Грамотрицательные оксидазоотрицательные не образующие спор палочки, способные расти на дифференциальных лактозных средах, ферментирующие лактозу до кислоты, альдегида и газа при температуре 37 °С в течение 24 — 48 ч. Примечание — Индикаторная группа бактерий, указывающая на возможность фекального загрязнения воды | de Coliforme en coliform organisms fr organismes coliformes | |
64 термотолерантные колиформные бактерии; термотолерантные колиформы: Бактерии, обладающие признаками общих колиформных бактерий, а также способные ферментировать лактозу до кислоты, альдегида и газа при температуре 44 °С в течение 24 ч. Примечание — Индикаторная группа бактерий, указывающая на фекальное загрязнение воды | de thermotolerante Coliforme Fäkalcoliforme en thermotolerant/faecal coliform organisms fr organismes coliformes thermotolerants | |
65 Esherichia coli; E. coli: Аэробные и факультативно анаэробные термоустойчивые колиформные бактерии, которые ферментируют лактозу или маннитол при температуре 44 °С в течение 24 ч с образованием кислоты и газа, а также производят индол из триптофана. Примечание — Индикаторная группа бактерий, включающая в себя преимущественно E. coli и указывающая на фекальное загрязнение воды | de Esherichia coli (E. Coli) en Esherichia coli (E. Coli) fr Esherichia coli (E. Coli) | |
66 сульфитредуцирующие клостридии: Спорообразующие анаэробные палочковидные бактерии, редуцирующие сульфиты до сульфидов. Примечания 1 Широко распространены в почве, поверхностных и сточных водах, часто встречаются в фекалиях. 2 Споры сульфитредуцирующих клостридий, являясь более устойчивыми по сравнению с вегетативными формами бактерий к воздействию неблагоприятных физических и химических факторов, используются как индикатор качества обработки при водоподготовке питьевой воды | de sulfitreduzierende Clostridien en sulphite-reducing clostridia fr clostridium sulfito-reducteurs | |
67** фекальные стрептококки: Грамположительные каталазотрицательные полиморфные кокки, располагающиеся попарно или в цепочках, способные расти на питательных средах с азидом натрия. Примечания 1 Индикаторная группа фекальных стрептококков включает в себя виды энтерококков, имеющих антиген группы Д. 2 Обнаружение фекальных стрептококков в воде, даже в отсутствие Е. coli, указывает на фекальное загрязнение воды | de Fäkalstreptokokken en faecal streptococci fr streptocoques fecaux | |
68* колифаги: Бактериальные вирусы, способные лизировать Е. coli и формировать при температуре 37 °С через 18 — 24 ч зоны лизиса на питательном агаре. Примечание — Из-за сходства с кишечными вирусами человека и большой устойчивости по сравнению с индикаторными группами бактерий их рассматривают как показатели возможного вирусного загрязнения воды | en coliphages fr coliphages | |
69** наиболее вероятное число; НВЧ: Вероятностная оценка числа микроорганизмов в определенном объеме воды, полученная из сочетания положительных и отрицательных результатов в серии объемов пробы, исследованных стандартными методами с использованием жидких питательных сред | de wahrscheinlichste Zahl; MPN en most probable number; MPN fr nombre le plus probable; NPP | |
70** вибрионы: Грамотрицательные оксидазоположительные водные бактерии, имеющие форму изогнутых палочек, способные передвигаться с помощью жгутиков. Примечание — Некоторые виды вибрионов патогенны для человека (например, Vibrio cholera и Vibrio parahaemolyticus) | de Vibrio sp. en Vibrio sp. fr Vibrio sp. | |
71 легионеллы: Разновидность патогенных для человека грамотрицательных бактерий, оптимальной температурой для развития которых является 30 — 45 °С и которые могут медленно развиваться при температуре 20 °С и переносить температуру 55 °С. Примечания 1 Выделяются из поверхностных вод, ила, термально загрязненных озер и источников, а также распределительных систем питьевого и горячего водоснабжения. 2 Служат возбудителями пневмонии «болезни легионеров» и лихорадки Понтиака. Путь передачи инфекции — через водные аэрозоли | de Legionella species en Legionella species fr bacteries Legionella | |
72 род Псевдомонады: Аэробные грамотрицательные оксидазоположительные каталазположительные бактерии, не образующие спор, повсеместно распространенные в водной среде. Примечания 1 Используют для своего роста простые органические и неорганические соединения, вследствие чего хорошо размножаются при попадании в питьевую воду, не содержащую хлора (или других обеззараживающих агентов), в частности в воде, расфасованной в емкости. 2 Широко распространенным видом псевдомонад, длительно выживающим в водной среде, является синегнойная палочка (Pseudomonas aeruginosa) — условно-патогенный микроорганизм, способный вызывать раневые и кишечные инфекции | de Pseudomonas species en Pseudomonas species fr bacteries Pseudomonas | |
73* цисты лямблий: Временная форма существования лямблий, обеспечивающая их выживание во внешней среде, переход от одного организма-хозяина к другому | en Giardia cysts | |
азот по Кьельдалю 44
аммонизация воды 23
бактерии колиформные общие 63
бактерии колиформные термотолерантные 64
вещества взвешенные в воде 41
вибрионы 70
вода артезианская 6
вода дождевая 8
вода минеральная 4
вода морская 7
вода питьевая 3
вода подземная 5
водоросли 58
водоснабжение питьевое 1
гиперхлорирование воды 21
деионизация воды 19
дестратификация водного объекта 14
дехлорирование воды 22
дистилляция воды 18
зоопланктон 56
Esherichia coli 65
Е. coli 65
coli 65
индекс фенольный 51
источник питьевого водоснабжения 9
клостридии сульфитредуцирующие 66
колифаги 68
колиформы общие 63
колиформы термотолерантные 64
консервация пробы воды 40
легионеллы 71
макрофиты 57
материал ионообменный 26
микроорганизмы индикаторные 61
микроорганизмы санитарно-показательные 62
микроорганизмы сапрофитные водные 59
море 12
НВЧ 69
нормативы качества питьевой воды гигиенические 2
озонирование воды 24
окисляемость бихроматная 46
окисляемость перманганатная 45
ОМЧ 60
отбор проб воды автоматический 36
отложения донные 53
планктон 54
пленка зооглейная 27
порог восприятия запаха воды 47
проба воды 33
проба воды составная 35
проба воды точечная 34
пробоотборник 39
род Псевдомонады 72
родник 10
ручей 11
сеть пунктов отбора проб воды 38
система питьевого водоснабжения автономная 32
система питьевого водоснабжения нецентрализованная 31
система питьевого водоснабжения централизованная 30
содержание нефтепродуктов в воде 52
содержание примесей в воде общее 42
стрептококки фекальные 67
стратификация водного объекта 13
точка отбора пробы воды 37
трофность водного объекта 15
устройства водоочистные 28
устройства водоочистные бытовые 29
фильтрование воды 16
фильтрование воды мембранное 17
фитопланктон 55
флокулянт 25
хлор остаточный 48
хлор свободный 49
хлор связанный 50
хлорирование воды 20
число микробное общее 60
число наиболее вероятное 69
цисты лямблий 73
электропроводность воды удельная 43
Алфавитныйуказательэквивалентовтерминовнанемецкомязыке
Algen 58
Aminierung 23
automatische Probenahme 36
Bach 11
Chlorung 20
Coliforme 63
Destratifizierung 14
Destillation 18
elektrische Leitfähigkeit 43
Entchlorung 22
Entionisierung 19
Esherichia coli (E. Coli) 65
Coli) 65
Fäkalstreptokokken 67
Fäkalcoliforme 64
Filtration 16
Flockungshilfsmittel 25
freies Chlor 49
gesamter Feststoffgehalt 42
gesamtes Restchlor 48
Geruchsschwelle 47
hygienisches indikator Mikroorganismus 62
Indikator-mikroorganismus 61
Ionenaustauschmaterial 26
Koloniezahl 60
Kjeldahl-Stickstoff 44
Legionella species 71
Makrophyten 57
Meer 12
Membranfiltration 17
Mineralwasser 4
Mischprobe 35
Ozonisierung 24
Permanganat-Index (von Wasser) 45
Phytoplankton 55
Plankton 54
Probe 33
Probenahmestelle 37
Probenahmenetz 38
Probenehmer 39
Probenstabilisierung 40
Pseudomonas species 72
Quelle 10
Regenwasser 8
Schichtung 13
Stichprobe 34
Stoßchlorung 21
sulfitreduzierende Clostridien 66
suspendierte Feststoffe 41
thermotolerante Coliforme 64
trinkbares Wasser 3
troph 15
Vibrio sp. 70
70
wahrscheinlichste Zahl; MPN 69
wasser saprophitare Mikroorganismus 59
Zoogloenfilm 27
Zooplankton 56
Алфавитныйуказательэквивалентовтерминовнаанглийскомязыке
algae 58
ammonization 23
automatic sampling 36
centralization system of drinking water supply 30
chlorination 20
coliform organisms 63
coliphages 68
composite sample 35
decrnorination 22
decentralization system of drinking water supply 31
deionization 19
destratification 14
distillation 18
drinking water 3
drinking water supply 1
electrical conductivity 43
Esherichia coli (E. Coli) 55
faecal streptococci 57
filtration 16
flocculation aid 25
free chlorine 49
Giardia cysts 73
indicating microorganisms 61
ion-exchange material 26
Kjeldahl nitrogen 44
Legionella species 71
macrophytes 57
membrane filtration 17
mineral water 4
most probable number; MPN 69
odour threshold 47
ozonization 24
permanganate index (of water) 45
phytoplankton 55
Plate count 60
plankton 54
Pseudomonas species 72
rain water 8
residual chlorine 48
sample 33
sample stabilization 40
sampler 39
sampling network 38
sampling point 37
sanitary-indicatory microorganisms 62
sea 12
spot sample 34
spring 10
stratification 13
stream 11
sulphite-reducing clostridia 66
superchlorination 21
suspended solids 41
thermotolerant/faecal coliform organisms 64
total solids 42
trophic 15
Vibrio sp. 70
70
water saprophyte microorganisms 59
zooplankton 56
zoogloeal film 27
Алфавитныйуказательэквивалентовтерминовнафранцузскомязыке
adjuvant de floculation 25
algues 58
ammoniaton 23
azote Kjeldahl 44
bacteries Legionella 71
bacteries Pseudomonas 72
chloration 20
chlore libre 49
chlore residuel 48
clostridium sulfito-reducteurs 66
coliphages 68
conductivite electrique 43
cours d’eau 11
dechloration 22
deionisation 19
destratification 14
distillation 18
eau de boisson 3
eau de pluie 8
eau minerale 4
echantillon 33
echantillon ponctuel 34
echantillon composite 35
echantillonnage automatique 36
echantillonneur 39
Esherichia coli (E. Coli) 65
filtration 16
filtration sur membrane 17
film de zooglee 27
indice permanganate (de l’eau) 45
macrophytes 57
matieres en suspension 41
matieres solides totales 42
matiere echangeuse d’ions 26
mer 12
nombre le plus probable; NPP 69
numeration sur plaque 60
organismes coliformes 63
organismes coliformes thermotolerants 64
ozonisation 24
phytoplancton 55
plancton 54
point d’echantillonnage 37
reseau d’echantillonnage 38
seuil olfactif 47
source 10
stabilisation de l’echantillon 40
stratification 13
streptocoques fecaux 67
surchloration 21
trophe 15
Vibrio sp. 70
70
zooplancton 56
Термины и определения понятий, необходимые для понимания текста стандарта
А.1 агломерация: Соединение мелких хлопьев или частиц взвешенных веществ с образованием больших хлопьев или частиц взвешенных веществ в воде
А.2 коагуляция: Процесс укрупнения коллоидных и взвешенных частиц
А.3 флокуляция: Агломерация с применением флокулянта
А.4** флотация: Процесс отделения диспергированных и коллоидных примесей от воды, основанный на способности частиц прилипать к воздушным или газовым пузырькам и переходить вместе с ними в пенный слой
А.5 денитрификация: Уменьшение содержания в воде нитритных или нитратных ионов путем воздействия бактерий
А.6 седиментация: Осаждение и отложение в воде взвешенного вещества под действием силы тяжести
А.7* коагулянт: Вещество, стимулирующее укрупнение и осаждение взвешенных и коллоидных частиц, находящихся в воде
А. 8 биота: Живые компоненты экосистемы
8 биота: Живые компоненты экосистемы
А.9 анаэробные организмы; анаэробы: Организмы, не требующие для выживания или размножения присутствия растворенного или газообразного кислорода
А.10 аэробные организмы; аэробы: Организмы, требующие для выживания или размножения присутствия растворенного или газообразного кислорода
А.11 факультативные аэробы: Организмы, обычно анаэробные, но выживающие и слабо размножающиеся в присутствии кислорода
А.12 факультативные анаэробы: Организмы, обычно аэробные, но выживающие или размножающиеся в отсутствие кислорода
А.13** гетеротрофность: Тип питания, при котором в качестве источника углерода используются органические соединения
А.14* микроорганизмы: Группа организмов, невидимых невооруженным глазом
А.15 термофильные микроорганизмы: Микроорганизмы, которые развиваются при температуре более 45 °С
А.16 психрофильные микроорганизмы: Микроорганизмы, которые развиваются при температуре менее 20 °С
А. 17 мезофильные микроорганизмы: Микроорганизмы, которые развиваются при температуре от 20 до 45 °С
17 мезофильные микроорганизмы: Микроорганизмы, которые развиваются при температуре от 20 до 45 °С
А.18* патогенные микроорганизмы: Микроорганизмы, способные вызывать заболевания людей, животных или растений
А.19* условно-патогенные микроорганизмы: Микроорганизмы, которые в обычных условиях обитания в организме человека или животных не вызывают инфекционного процесса, но могут стать причиной заболевания
А.20 фотоавтотрофные бактерии: Бактерии, использующие для метаболизма энергию света и диоксид углерода
А.21** сальмонеллы: Род бактерий семейства Enterobacteriaceae.
Примечание — Патогенные бактерии, способные вызывать кишечные инфекции, в том числе брюшной тиф, паратифы
А.22 лямблии: Одноклеточные паразиты кишечника человека и животных, род жгутиконосцев класса зоомастигин
А.23** вирусы: Группа ультрамикроскопических внутриклеточных паразитов, состоящих из нуклеиновой кислоты, окруженной защитной протеиновой или смешанной оболочкой из протеинов, липидов и углеводов
А. 24** кишечные вирусы: Вирусы, способные размножаться в желудочно-кишечном тракте человека и животных, обитать или транзитно проходить через него и выделяться с фекалиями в окружающую среду.
24** кишечные вирусы: Вирусы, способные размножаться в желудочно-кишечном тракте человека и животных, обитать или транзитно проходить через него и выделяться с фекалиями в окружающую среду.
Примечания
1 К представителям кишечных вирусов относится род энтеровирусов: поливирусы, Коксаки А и В, ECHO, энтеровирусы 68 — 71. В широкую группу кишечных вирусов входят также ротавирусы, отдельные представители аденовирусов, коронавирусы, калицивирусы, реовирусы, вирусы гепатита А и Е, вирусы Норволк, астровирусы, мелкие аденоассоциированные вирусы.
2 Кишечные вирусы вызывают заболевания в различных клинических формах. Заражение осуществляется энтеральным механизмом передачи
А.25** бактериофаг: Вирус, способный инактивировать бактериальную клетку, репродуцироваться в ней и вызывать ее лизис или переход в лизогенное состояние
А.26* паразит: Организм, использующий в качестве источника питания или среды обитания другие организмы, нанося им в большинстве случаев вред
А. 27* гельминты: Группа червей-паразитов, вызывающих гельминтозы.
27* гельминты: Группа червей-паразитов, вызывающих гельминтозы.
Примечание — Яйца гельминтов — стадия жизненного цикла, обеспечивающая выживание вне хозяина, распространение и передачу заболевания
Ключевые слова: вода, качество воды, водоподготовка, отбор проб, анализ воды, водораспределительные системы, материалы для водоподготовки |
Перманганатная окисляемость воды — waterservice-dmitrov.ru
Перманганатная окисляемость – показатель содержания в воде органических и минеральных веществ, удерживающих преобразование железа из двухвалентного в трехвалентное, которое может быть окислено кислородом, и позволяющий судить о загрязнении воды в целом. Именно ее определение предусмотрено действующими нормативными документами (ПНД Ф 14.2:4.154-99, ИСО 8467).
Также перманганатная окисляемость является единственным показателем химического потребления кислорода (ХПК), регламентирующим качество питьевой воды. Согласно СанПиН 2. 1.4.1175-02 «Гигиенические требования к качеству воды нецентрализованного водоснабжения» ПДК питьевой воды по перманганатной окисляемости составляет 5,0-7,0 мг/л.
1.4.1175-02 «Гигиенические требования к качеству воды нецентрализованного водоснабжения» ПДК питьевой воды по перманганатной окисляемости составляет 5,0-7,0 мг/л.
Важность этого параметра столь велика, что он в одиночку способен определить конфигурацию фильтров для коттеджей, в которых происходит удаление железа из воды. Логика подсказывает, что чем меньше показатель – тем лучше, ведь тогда можно использовать не требующие эксплуатационных расходов безреагентные фильтры для коттеджей. Что ж, логика чертовски права: окисляемость 1-2 единицы – прекрасно, 5-6 – терпимо, 8-10 – очень плохо, ну а если ещё больше – катастрофа!
Высокий показатель перманганатной окисляемости свидетельствует, как правило, о присутствии среди органических веществ (гуминовые кислоты, растительная органика, антропогенные «подарочки» и т.д.) значительной доли железобактерий. Эти самые бактерии знамениты своим «выдающимся» свойством удерживать растворённое двухвалентное железо в стабильной форме, в разы увеличивая время необходимое для его окисления. Удаление железа из воды, основанное на его окислении в аэрационной колонне, в данной ситуации будет не эффективным.
Удаление железа из воды, основанное на его окислении в аэрационной колонне, в данной ситуации будет не эффективным.
В таких случаях используются реагентные фильтры, позволяющие порционно вводить мощные окислители (озон, перманганат калия, гипохлорит натрия и т.п.). Установка таких фильтров и регулярная замена реагентов, безусловно, в разы дороже.
Единственным рациональным решением, позволяющим избежать этой проблемы, является изменение места и глубины бурения. Переход на более глубокие грунтовые водные слои.
Отбор проб при определении перманганатной окисляемости
Для отбора проб используются бутыли из полимерного материала или стекла. Определение следует проводить как можно скорее.
Если проба не может быть проанализирована сразу же после отбора, то для предотвращения биохимического окисления органических соединений пробу необходимо подкислить до рН менее 2, для чего на 1 л воды добавляют 10 мл серной кислоты (1:3).
Максимальный рекомендуемый срок хранения проб для данного анализа зависит от способа консервации пробы. При использовании стеклянных бутылей максимально рекомендуемый срок хранения подкисленной пробы — 2 суток при условии ее охлаждения до 2–5 °С и хранения в темном месте. При отборе проб в полимерные бутыли их допускается хранить до 1 мес. при условии замораживания до минус 20 °С.
При использовании стеклянных бутылей максимально рекомендуемый срок хранения подкисленной пробы — 2 суток при условии ее охлаждения до 2–5 °С и хранения в темном месте. При отборе проб в полимерные бутыли их допускается хранить до 1 мес. при условии замораживания до минус 20 °С.
ГОСТ Р 55684-2013 Вода питьевая. Метод определения перманганатной окисляемости
Перманганатная окисляемость превышение в доме
Недавно получили в комментариях вопрос: «Перманганатная окисляемость превышение в многоэтажном доме — причины и последствия?» Анализ воды с помощью нюха показал запах гнили. А анализ воды в лаборатории показал превышение перманганатной окисляемости. Дом 1970 года постройки, трубы ни разу не менялись. Постараемся ответить на вопрос
Перманганатная окисляемость — это показатель общего количества органических веществ в воде. Он не показывает, какие именно вещества присутствуют, но показывает, сколько их в сумме. Назван показатель по способу получения значения — в пробу воды добавляется марганцовка (перманганат калия). Окисляемость — это потому, что окисленные «до упора» формы органических веществ не взаимодействуют с марганцовкой. То есть, окисляются все вещества до этого «упора», и считается количество затраченной марганцовки. Результат — интересное значение перманганатной окисляемости.
Окисляемость — это потому, что окисленные «до упора» формы органических веществ не взаимодействуют с марганцовкой. То есть, окисляются все вещества до этого «упора», и считается количество затраченной марганцовки. Результат — интересное значение перманганатной окисляемости.
Первый вывод о превышении перманганатной окисляемости:
Само по себе превышение показателя «Перманганатная окисляемость» говорит всего-навсего о том, что в воде избыток органических веществ. Показатель не говорит, хорошие это вещества, плохие, нужные, ненужные. Просто их много.
Другое дело — это откуда взялись эти вещества и каковы последствия их избытка.
Источник органики в водопроводных трубах — водоросли.
За десятки лет работы на внутренних стенках труб развиваются колонии водорослей. Это не привычные нам водоросли из реки. Это особые водоросли, способные жить без света и более-менее устойчивые к хлорированной воде. Практически каждый пользователь водопровода может обнаружить эти водоросли в своём водопроводе. Ими богаты внутренние стенки унитаза — самый лёгкий источник проверки. Более сложный путь — выкрутить ключом аэратор крана (его всё равно стоит иногда выкручивать и промывать, чтобы поток воды был больше), и сунуть палец внутрь крана. Слизь на ощупь — это те самые микроорганизмы.
Ими богаты внутренние стенки унитаза — самый лёгкий источник проверки. Более сложный путь — выкрутить ключом аэратор крана (его всё равно стоит иногда выкручивать и промывать, чтобы поток воды был больше), и сунуть палец внутрь крана. Слизь на ощупь — это те самые микроорганизмы.
Чтобы бороться с водорослями и другими микроорганизмами, воду хлорируют на Водоканале. В некоторых городах вместо хлора используют фтор, сути дела это не меняет.
Водоросли — отличный источник пищи для бактерий — если они смогут выжить в хлорированной воде и укорениться в слое водорослей. Чем старше дом, тем больше слой слизи на трубах. И тем больше мест, куда могут спрятаться бактерии от хлорирования. Бактерии, живущие в темноте и без кислорода воздуха — это обычно гнилостные бактерии.
Гнилостные бактерии разлагают слой водорослей с выделением неприятного запаха.
То есть, весьма вероятная причина запаха воды в данном случае — бактерии, пирующие в слое водорослей. Молекулы этого запаха также могут давать вклад в превышение перманганатной окисляемости.
Теперь о том, чем грозит превышение перманганатной окисляемости.
Само по себе, превышение не грозит ничем. Чтобы оценить угрозу, необходимо знать, какие именно органические вещества присутствуют — а это дополнительные химические анализы и дополнительные затраты. Поэтому, возможно, дешевле применить комплексные методы воздействия:
на уровне дома — хлорирование
на уровне квартиры — фильтр для воды.
В многоэтажных домах проводят регулярное хлорирование воды — по трубам проходит намного большая концентрация хлора, чем обычно. Результат — слой водорослей вместе с бактериями умирает. Естественно, если слой водорослей толстый, то обычного повышения концентрации маловато, и нужно повысить дозу. Возможно, обращение в Водоканал с результатами анализа воды может помочь исправить ситуацию.
Но практика обращений в Водоканалы показывает ничтожный положительный результат. Поэтому чаще всего выбирают второй путь решения проблемы — фильтрация воды.
Рекомендации по поводу фильтров для воды от неприятного запаха:
Фильтры на входе в дом — картриджи с активированным углём. Они как раз предназначены для удаления неприятного запаха и привкуса воды. Перед установкой можно дополнительно проконсультироваться у производителя, решат ли фильтры задачу.
Фильтр для воды — оптимально обратный осмос и минерализатор по желанию, так как гарантированно удаляются всевозможные вредные вещества, в том числе и микроорганизмы с водорослями.
Надеемся, мы полностью ответили на вопрос. Если нет — уточняйте в комментариях!
Пермаганатная окисляемость воды
Пермаганатная окисляемость характеризует соджержание в воде органических и минеральных веществ, удерживающих преобразование железа из двухвалентного в трехвалентное, которое может быть окислено кислородом. Т.е. пермаганатная окисляемость определяет именно то количество кислорода, которое спасет положение, причем из расчета на один литр исходной воды. Чем ниже окисляемость, тем меньше расходов и усилий на преобразование воды в пригодную. 1-2 единицы — вполне хороший показатель пермагантаной окисляемости, 4-6 — в пределах нормы, а выше — уже непреемлемый показатель.
| Не знаете, как понизить окисляемость воды? — Вам нужен многофункциональный фильтр, подробнее здесь или у онлайн консультанта. | |||
От пермаганатной окисляемости зависит состав системы водоподготовки и водочистки всего дома. Даже если химический состав в двух скважинах по содержанию железа и органики одинаков, показатели пермаганатной окисляемости могут сильно разнится, что сделает возможным, или невозможным установку безреагентных фильтров в одном из домов.
Как правило высокий показатель пермаганатной окисляемости говорит о содержании в воде определенных биологическихз веществ именуемых железобактериями (гуминовые кислоты, растительная органика, органика антропогенная и т. д.). Они активно удерждивают двухвалентное железо в стабильной форме.
д.). Они активно удерждивают двухвалентное железо в стабильной форме.
Источником повышенной загрязненности воды железобактериями является в большинстве случаев человеческая деятельность, а проще говоря, слив отходов. Поверхностные воды имеют более высокую окисляемость по сравнению с подземными, она насыщенна органикой с почвы и опадающей в воду органикой. На окисляемость влияет водообмен между водоемами и грунтовыми водам. Она имеет выраженную сезонность. Вода равнинных рек как правило имеет окисляемость 5-12 мг О2 /дм3, рек с болотным питанием — десятки миллиграммов на 1 дм3. Подземные воды имеют в среднем окисляемость на уровне от сотых до десятых долей миллиграма О2 /дм3. ПДК питьевой воды по перманганатной окисляемости согласно СанПиН 2.1.4.1175-02 «Гигиенические требования к качеству воды нецентрализованного водоснабжения. Санитарная охрана источников» составляет 5,0-7,0 мг/дм3.
Различают несколько видов окисляемости воды: перманганатную, бихроматную, иодатную. Наиболее высокая степень окисления достигается бихроматным методом. В практике водоочистки для природных малозагрязненных вод определяют перманганатную окисляемость, а в более загрязненных водах — как правило, бихроматную окисляемость (ХПК — «химическое потребление кислорода»).
Наиболее высокая степень окисления достигается бихроматным методом. В практике водоочистки для природных малозагрязненных вод определяют перманганатную окисляемость, а в более загрязненных водах — как правило, бихроматную окисляемость (ХПК — «химическое потребление кислорода»).
В таких случаях используются реагентные фильтры, позволяющие порционно вводить мощные окислители (озон, перманганат калия, гидрохлорит натрия и т.п.). Установка таких фильтров и регулярная замена реагентов, безусловно, в разы дороже. Обычная аэрация в таких случая практически неэффективна.
Единственным рациолнальным решением, позволяющим избежать этой проблемы, является изменение места и глубины бурения. Переход на более глубокие грунтовые водные слои.
С точки зрения влияния на состояние челковека, то при высокой пермаганатной окисляемости наиболее опасны для человека крупные органические соединения, которые на 90% являются канцерогенами или мутагенами. Опасны хлорорганические соединения, образующиеся при кипячении хлорированной воды, т.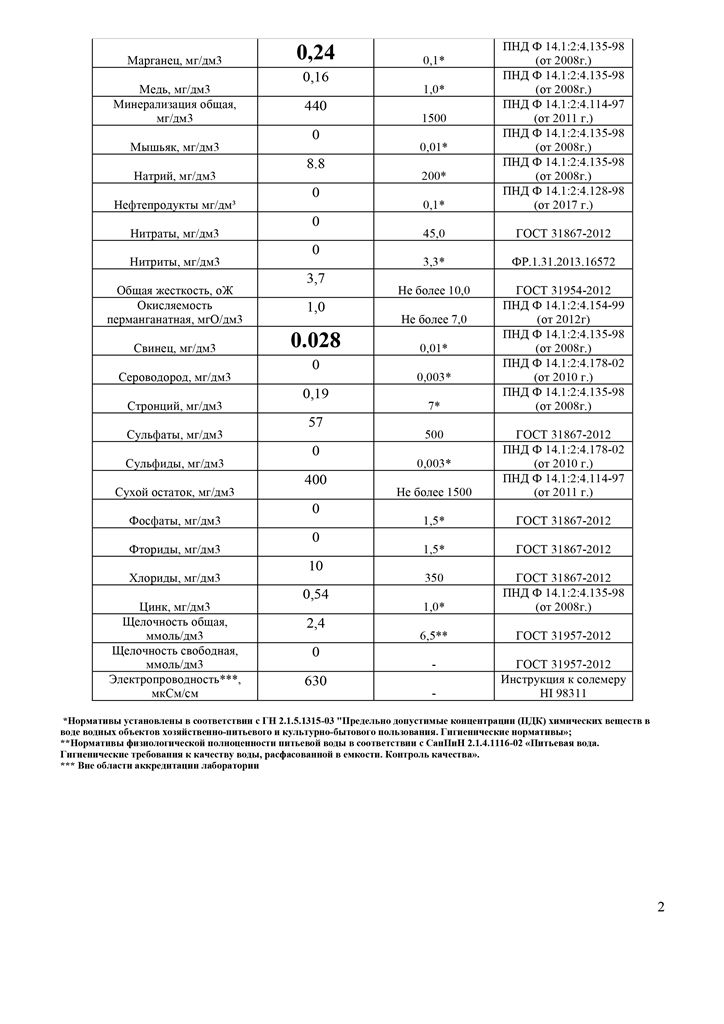 к. они являются сильными канцерогенами, мутагенами и токсинами. Остальные 10% крупной органики в лучшем случае нейтральны в отношении организма. Полезных для человека крупных органических соединений, растворенных в воде, всего 2-3 (это ферменты, необходимые в очень малых дозах). Воздействие органики начинается непосредственно после питья. В зависимости от дозы это может быть 18-20 дней или, если доза большая, 8-12 месяцев. И исходя из логики наличие железобактерий препятствует удалению железа из воды. О Влиянии железа на организм человека можно проичтать в этой статье.
к. они являются сильными канцерогенами, мутагенами и токсинами. Остальные 10% крупной органики в лучшем случае нейтральны в отношении организма. Полезных для человека крупных органических соединений, растворенных в воде, всего 2-3 (это ферменты, необходимые в очень малых дозах). Воздействие органики начинается непосредственно после питья. В зависимости от дозы это может быть 18-20 дней или, если доза большая, 8-12 месяцев. И исходя из логики наличие железобактерий препятствует удалению железа из воды. О Влиянии железа на организм человека можно проичтать в этой статье.
Окисляемость, или химическое потребление кислорода (ХПК)
А.Н. Петин, М.Г. Лебедева, О.В. Крымская
Анализ и оценка качества поверхностных вод
Учебное пособие. – Белгород: Изд-во БелГУ, 2006. – 252 с.
1.3. Растворенный в воде кислород
1.3.2. Окисляемость, или химическое потребление кислорода (ХПК)
Величина, характеризующая содержание в воде органических и минеральных веществ, окисляемых одним из сильных химических окислителей при определенных условиях, называется окисляемостью. Существует несколько видов окисляемости воды: перманганатная, бихроматная, иодатная, цериевая. Наиболее высокая степень окисления достигается методами бихроматной и иодатной окисляемости воды.
Существует несколько видов окисляемости воды: перманганатная, бихроматная, иодатная, цериевая. Наиболее высокая степень окисления достигается методами бихроматной и иодатной окисляемости воды.
Окисляемость выражается в миллиграммах кислорода, пошедшего на окисление органических веществ, содержащихся в 1 дм3 воды.
Состав органических веществ в природных водах формируется под влиянием многих факторов. К числу важнейших относятся внутриводоемные биохимические процессы продуцирования и трансформации, поступления из других водных объектов, с поверхностными и подземными стоками, с атмосферными осадками, с промышленными и хозяйственно-бытовыми сточными водами. Образующиеся в водоеме и поступающие в него извне органические вещества весьма разнообразны по своей природе и химическим свойствам, в том числе по устойчивости к действию разных окислителей. Соотношение содержащихся в воде легко- и трудноокисляемых веществ в значительной мере влияет на окисляемость воды в условиях того или иного метода ее определения.
В поверхностных водах органические вещества находятся в растворенном, взвешенном и коллоидном состояниях. Последние в рутинном анализе отдельно не учитываются, поэтому различают окисляемость фильтрованных (растворенное органическое вещество) и нефильтрованных (общее содержание органических веществ) проб.
Величины окисляемости природных вод изменяются в пределах от долей миллиграммов до десятков миллиграммов в литре в зависимости от общей биологической продуктивности водоемов, степени загрязненности органическими веществами и соединениями биогенных элементов, а также от влияния органических веществ естественного происхождения, поступающих из болот, торфяников и т.п. Поверхностные воды имеют более высокую окисляемость по сравнению с подземными (десятые и сотые доли миллиграмма на 1 дм3), исключение составляют воды нефтяных месторождений и грунтовые воды, питающиеся за счет болот. Горные реки и озера характеризуются окисляемостью 2–3 мг О/дм3, реки равнинные – 5–12 мг О/дм3, реки с болотным питанием – десятки миллиграммов на 1 дм3. |
Окисляемость подвержена закономерным сезонным колебаниям. Их характер определяется, с одной стороны, гидрологическим режимом и зависящим от него поступлением органических веществ с водосбора, с другой – гидробиологическим режимом.
В водоемах и водотоках, подверженных сильному воздействию хозяйственной деятельности человека, изменение окисляемости выступает как характеристика, отражающая режим поступления сточных вод. Для природных малозагрязненных вод рекомендовано определять перманганатную окисляемость; в более загрязненных водах определяют, как правило, бихроматную окисляемость (ХПК).
В соответствии с требованиями к составу и свойствам воды водоемов у пунктов питьевого водопользования величина ХПК не должна превышать 15 мг О/дм3; в зонах рекреации в водных объектах допускается величина ХПК до 30 мг О/дм3. |
В программах мониторинга ХПК используется в качестве меры содержания органического вещества в пробе, которое подвержено окислению сильным химическим окислителем. ХПК применяют для характеристики состояния водотоков и водоемов, поступления бытовых и промышленных сточных вод (в том числе, и степени их очистки), а также поверхностного стока (табл. 18).
ХПК применяют для характеристики состояния водотоков и водоемов, поступления бытовых и промышленных сточных вод (в том числе, и степени их очистки), а также поверхностного стока (табл. 18).
Для вычисления концентрации углерода, содержащегося в органических веществах, значение ХПК (мг О/дм3) умножается на 0,375 (коэффициент, равный отношению количества вещества – эквивалента углерода к количеству вещества – эквивалента кислорода).
Таблица 18
Величины ХПК в водоемах с различной степенью загрязненности [1]
Степень загрязнения (классы водоемов) | ХПК, мг О/дм3 |
Очень чистые | 1 |
Чистые | 2 |
Умеренно загрязненные | 3 |
Загрязненные | 4 |
Грязные | 5–15 |
Очень грязные | >15 |
Присутствующие в воде органические соединения могут претерпевать не только аэробное биохимическое окисление в результате жизнедеятельности бактерий, используемое при определении БПК. При наличии в пробе воды сильных окислителей и соответствующих условий протекают химические реакции окисления органических веществ, причем характеристикой процесса химического окисления, а также мерой содержания в пробе органических веществ является потребление в реакции кислорода, химически связанного в окислителях. Показатель, характеризующий суммарное содержание в воде органических веществ по количеству израсходованного на окисление химически связанного кислорода, называется химическим потреблением кислорода (ХПК).
При наличии в пробе воды сильных окислителей и соответствующих условий протекают химические реакции окисления органических веществ, причем характеристикой процесса химического окисления, а также мерой содержания в пробе органических веществ является потребление в реакции кислорода, химически связанного в окислителях. Показатель, характеризующий суммарное содержание в воде органических веществ по количеству израсходованного на окисление химически связанного кислорода, называется химическим потреблением кислорода (ХПК).
Являясь интегральным (суммарным) показателем, ХПК в настоящее время считается одним из наиболее информативных показателей антропогенного загрязнения вод. Этот показатель, в том или ином варианте, используется повсеместно при контроле качества природных вод, исследовании сточных вод и др. Результаты определения окисляемости выражаются в миллиграммах потребленного кислорода на 1 л воды (мгО/л).
Однако не все органические вещества в равной степени участвуют в реакции химического окисления. Так же, как и при биохимическом окислении, при химическом окислении можно выделить группы легко, нормально и тяжело окисляющихся органических веществ. Поэтому всегда существует разница между теоретически возможным и практически достигаемым значениями ХПК.
Так же, как и при биохимическом окислении, при химическом окислении можно выделить группы легко, нормально и тяжело окисляющихся органических веществ. Поэтому всегда существует разница между теоретически возможным и практически достигаемым значениями ХПК.
Теоретическим значение ХПК (ХПКтеор) называют количество кислорода (или окислителя в пересчете на кислород) в мг/л, необходимое для полного окисления содержащихся в пробе органических веществ, т.е. всех способных окисляться элементов из состава органического соединения. При таком окислении углерод теоретически количественно окисляется до СО2, а сера и фосфор (если они присутствуют в соединении) – до SО3 и Р2О5. Азот превращается в аммонийную соль; кислород, входивший в состав окисляемых органических молекул, является «строительным материалом» для образующихся продуктов окисления, а водород переходит в структуру Н2О или аммонийной соли.
Например, при окислении синильной кислоты и гликоля протекают реакции:
Практически используемые методы определения ХПК дают результаты, близкие к ХПКтеор, но всегда отклоняющиеся в ту или иную сторону. При наличии трудно окисляющихся органических веществ их окисление за время реакции проходит не полностью, и это приводит к занижению результата. В то же время, при наличии в пробе неорганических восстановителей, также потребляющих кислород на собственное окисление, результат получается завышенный. Совместное действие обоих факторов и вызывает отклонение реального ХПК от ХПКтеор.
При наличии трудно окисляющихся органических веществ их окисление за время реакции проходит не полностью, и это приводит к занижению результата. В то же время, при наличии в пробе неорганических восстановителей, также потребляющих кислород на собственное окисление, результат получается завышенный. Совместное действие обоих факторов и вызывает отклонение реального ХПК от ХПКтеор.
Таким образом, окисляемость, или ХПК, характеризует общее количество содержащихся в воде восстановителей (органических и неорганических), реагирующих с сильными окислителями. В качестве таких окислителей обычно используют бихромат- и перманганат-анионы, и соответственно называются основные методы определения ХПК — бихроматный и перманганатный. Следует отметить, что результаты определения окисляемости одной и той же воды с помощью разных окислителей обычно неоднозначны из-за неодинаковой степени окисления веществ, присутствующих в воде. Результаты зависят также от свойств окислителя, его концентрации, температуры, рН, продолжительности окисления и др. Получаемые результаты сопоставимы только в том случае, когда точно соблюдены все условия проведения анализа.
Получаемые результаты сопоставимы только в том случае, когда точно соблюдены все условия проведения анализа.
Бихроматная окисляемость позволяет получить значение ХПК, наиболее приближенное к ХПКтеор, т.е. наиболее полное окисление достигается бихроматом калия. Поэтому определение бихроматной окисляемости является основным методом определения ХПК. Именно бихроматную окисляемость часто называют «химическим потреблением кислорода». В условиях этого метода большинство органических соединений окисляется на 95 % и более, однако окисляются не все соединения (толуол, бензол, пиридин, парафин и др. практически не окисляются). Катализатором окисления является сульфат серебра, который добавляется в аналитическую рецептуру для ускорения реакции и повышения полноты окисления органических веществ. Избыток бихромата оттитровывается раствором соли Мора. Реакцию проводят в жестких условиях – в 50 %-ной
(разбавление 1:1) серной кислоте при кипячении. Содержание неорганических восстановителей в пробе определяют отдельно специальными методами и вычитают из ХПК пробы.
Бихромат при этом восстанавливается согласно уравнению:
В таких условиях получаемый результат обычно составляет 95-98 % от ХПКтеор.
На примере окисления фталата калия бихроматом реакцию можно записать следующим образом:
Из уравнения реакции следует, что на окисление 2 молекул фталата калия расходуется 16 молекул кислорода, связанного в бихромате. В весовом отношении ХПКтеор для 1 мг фталата калия составляет 1,175 мгО.
Значения ХПКтеор (в мг кислорода на 1 мг вещества) для разных соединений, по данным [26], приведены в табл. 19.
Таблица 19
Значения ХПКтеор для разных соединений
Соединение | ХПКтеор, мгО/л |
Щавелевая кислота | 0,18 |
Синильная кислота | 0,59 |
Гликоль | 0,64 |
Глюкоза | 1,07 |
Уксусная кислота | 1,07 |
Сахароза | 1,12 |
Масляная кислота | 1,82 |
Этанол | 2,09 |
Додецилбензоат натрия | 2,34 |
Фенол | 2,38 |
Бутанол | 2,59 |
Бихроматная окисляемость определяется методом титрования. Соответствующие методики, с незначительными различиями, регламентированы как отечественными руководящими документами, так и международным стандартом ИСО 6060. Согласно методу титрования, избыток бихромата калия после операции окисления (уравнение реакции см. выше) оттитровывают солью Мора в присутствии индикатора, в качестве которого обычно используется ферроин – комплекс 1,10-фенатролина с сульфатом железа (II) (в качестве индикатора может быть также использована
Соответствующие методики, с незначительными различиями, регламентированы как отечественными руководящими документами, так и международным стандартом ИСО 6060. Согласно методу титрования, избыток бихромата калия после операции окисления (уравнение реакции см. выше) оттитровывают солью Мора в присутствии индикатора, в качестве которого обычно используется ферроин – комплекс 1,10-фенатролина с сульфатом железа (II) (в качестве индикатора может быть также использована
М-фенилантраниловая кислота). При этом катион Fе2+ в титранте реагирует с катионом хрома:
Индикатор образует интенсивно окрашенное соединение с Fе2+ и бесцветное – с Fе3+. По этой причине, когда восстановление Сгб+ до Сг3+ завершено, Fе2+ реагирует с индикатором с образованием ферроинового комплекса. При этом окраска раствора отчетливо изменяется от синевато-зеленой до красно-коричневой, что указывает момент окончания титрования. Момент окончания титрования может быть установлен также потенциометрически.
Для определения ХПК, наряду с окислением бихроматом, проводят также окисление перманганатом. Соответствующий показатель называется перманганатной окисляемостыо (за рубежом также используют термин «перманганатный индекс»). Перманганатная окисляемость является мерой загрязнения воды окисляемыми органическими и неорганическими веществами, способными к окислению в условиях анализа, и такими условиями являются окисление 0,01 н. раствором перманганата калия в сернокислой среде или кипячении в течение 10 мин.
Уравнение реакции при окислении пробы перманганатом можно записать следующим образом:
Для определения перманганатной окисляемости используется более простой метод, чем для бихроматной окисляемости, однако он имеет ограниченное применение. Так, определение перманганатной окисляемости может быть рекомендовано (и широко используется) лишь при анализе природных вод для контроля за динамикой содержания легкоокисляющихся веществ природного происхождения (например, гуминовых кислот).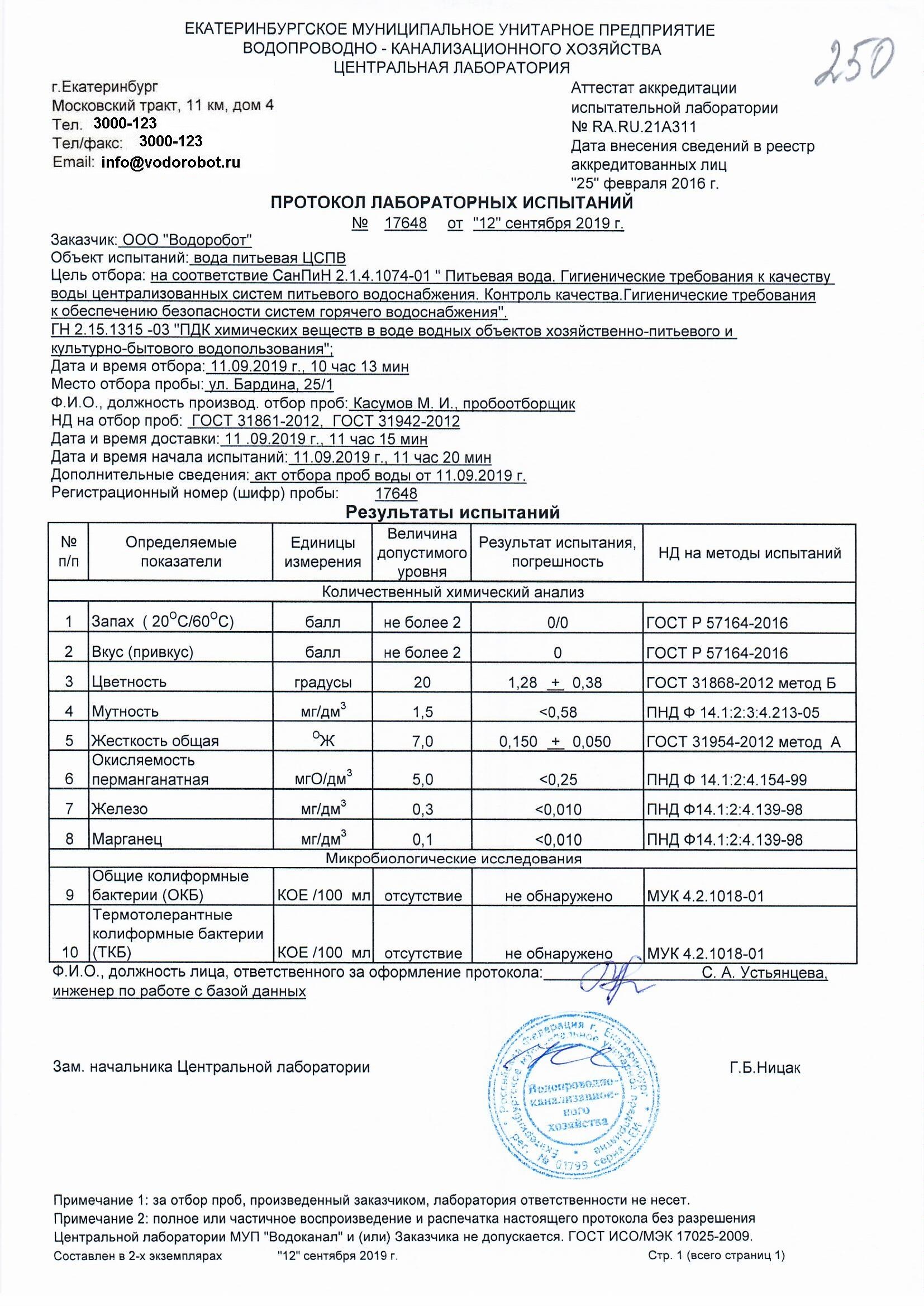 И это понятно, т.к. «жестко» окисляющиеся органические загрязнители, часто присутствующие в сточных водах, в природной воде практически не встречаются. Следует отметить также, что именно перманганатная окисляемость является единственным показателем ХПК, регламентирующим качество питьевой воды согласно СанПиН 2.1.4.559-96 (норматив составляет 5,0 мгО/л) [44] .
И это понятно, т.к. «жестко» окисляющиеся органические загрязнители, часто присутствующие в сточных водах, в природной воде практически не встречаются. Следует отметить также, что именно перманганатная окисляемость является единственным показателем ХПК, регламентирующим качество питьевой воды согласно СанПиН 2.1.4.559-96 (норматив составляет 5,0 мгО/л) [44] .
Определение перманганатной окисляемости может давать некорректные результаты при анализе сточных вод по следующим причинам:
1) перманганат – недостаточно сильный окислитель, поэтому окисление многих веществ проходит неполно или совсем не проходит;
2) при кипячении растворов, содержащих перманганат, последний разлагается до диоксида марганца и кислорода (как в кислой, так и в щелочной средах). Выпадающий диоксид марганца каталитически ускоряет процесс, однако в холостой пробе или относительно чистой воде этого не происходит. Процесс осложняется тем, что количество выпадающего диоксида марганца зависит от условий и состава анализируемой пробы.
Следует отметить, что в природных водах содержание трудно окисляющихся органических веществ обычно крайне мало, и результаты, получаемые при анализе природных вод бихроматным и перманганатным методами, практически достаточно близки.
Перманганатную окисляемость используют для оценки качества питьевой, водопроводной воды, природной воды источников водоснабжения и др. Ее определение предусмотрено ГОСТ 2761 при обследовании источников хозяйственно-питьевого водоснабжения. Более загрязненные поверхностные и сточные воды также, с известным приближением, можно анализировать этим методом, однако их необходимо разбавлять. Перманганатную окисляемость нельзя рассматривать как меру теоретического потребления кислорода или общего содержания органических веществ в воде, т.к. ряд органических соединений в условиях этого метода окисляется лишь частично.
Таким образом, для характеристики ХПК как показателя химической активности пробы, традиционно используются методы «мокрой» химии. Тем не менее, ХПК определяют также и «сухимии» приборными методами. Например, методами сжигания органических веществ пробы в токе кислорода или СО2. Эти методы также позволяют получить результаты, близкие ХПКтеор, однако требуют приборного оснащения, а приборы – соответствующего обслуживания, поверки и т.п.
Тем не менее, ХПК определяют также и «сухимии» приборными методами. Например, методами сжигания органических веществ пробы в токе кислорода или СО2. Эти методы также позволяют получить результаты, близкие ХПКтеор, однако требуют приборного оснащения, а приборы – соответствующего обслуживания, поверки и т.п.
Мешают точному определению ХПК в первую очередь, хлорид-анионы, как правило, содержащиеся в природных и, особенно, в сточных водах. Хлориды окисляются в условиях анализа до элементарного хлора, поэтому при содержании в пробе в концентрации свыше 300 мг/л их влияние устраняется (или минимизируется) путем добавления сульфата ртути (II) в количестве 22,2 мг Н2SО4 на 1 мг С1. Образующийся малодиссоциированный хлорид ртути (II) устойчив в присутствии большой концентрации серной кислоты и бихромата.
Определению также мешают нитриты, часто присутствующие в водах, прошедших биохимическую очистку. Для их устранения в пробу вводят по 10 мг сульфаминовой кислоты на 3 мг NО2— . При кипячении раствора нитрит-анионы удаляются в виде азота, а избыток сульфаминовой кислоты переходит в сульфат аммония:
При кипячении раствора нитрит-анионы удаляются в виде азота, а избыток сульфаминовой кислоты переходит в сульфат аммония:
Помимо хлоридов и нитритов, определению мешают сульфиды, сероводород и железо. Все указанные соединения, при их присутствии в пробе, могут быть определены индивидуально, и результат анализа на окисляемость, в таком случае, уменьшают на величину потребления кислорода этими соединениями. В частности, 1 мг Н2S соответствует 0,47 мг О; 1 мг NО2 – – 0,35 мг O; 1 мг Fе2+ – 0,14 мг О.
Нормативы на ХПК в воде водоемов: для питьевой воды – 5,0 мгО/л (для перманганатной окисляемости), ХПК – 15 мгО/л.
Анализ воды. Главный контрольно-испытательный центр питьевой воды. Химический анализ воды.
Окисляемость — это величина, характеризующая содержание в воде органических и минеральных веществ, окисляемых (при определенных условиях) одним из сильных химических окислителей. Этот показатель отражает общую концентрацию органики в воде. Природа органических веществ может быть самой разной — и гуминовые кислоты почв, и сложная органика растений, и химические соединения антропогенного происхождения. Для определения конкретных соединений используются другие методы.
Природа органических веществ может быть самой разной — и гуминовые кислоты почв, и сложная органика растений, и химические соединения антропогенного происхождения. Для определения конкретных соединений используются другие методы.
Перманганатная окисляемость выражается в миллиграммах кислорода, пошедшего на окисление этих веществ, содержащихся в 1 дм3 воды.
Различают несколько видов окисляемости воды: перманганатную, бихроматную, иодатную. Наиболее высокая степень окисления достигается бихроматным методом. В практике водоочистки для природных малозагрязненных вод определяют перманганатную окисляемость, а в более загрязненных водах — как правило, бихроматную окисляемость (ХПК — «химическое потребление кислорода»).
Величина окисляемости природных вод может варьироваться в широких пределах от долей миллиграммов до десятков миллиграммов О2 на литр воды. Поверхностные воды имеют более высокую окисляемость по сравнению с подземными. Это понятно — органика из почвы и растительного опада легче попадает в поверхностные воды, чем в грунтовые, чаще всего ограниченные глинистыми водоупорами. Вода равнинных рек как правило имеет окисляемость 5-12 мг О2 /дм3, рек с болотным питанием — десятки миллиграммов на 1 дм3. Подземные воды имеют в среднем окисляемость на уровне от сотых до десятых долей миллиграма О2 /дм3. Хотя подземные воды в районах нефтегазовых месторождений, и торфянников могут иметь очень высокую окисляемость.
Вода равнинных рек как правило имеет окисляемость 5-12 мг О2 /дм3, рек с болотным питанием — десятки миллиграммов на 1 дм3. Подземные воды имеют в среднем окисляемость на уровне от сотых до десятых долей миллиграма О2 /дм3. Хотя подземные воды в районах нефтегазовых месторождений, и торфянников могут иметь очень высокую окисляемость.
ПДК питьевой воды по перманганатной окисляемости согласно СанПиН 2.1.4.1175-02 «Гигиенические требования к качеству воды нецентрализованного водоснабжения. Санитарная охрана источников» составляет 5,0-7,0 мг/дм3.
Перманганатный индекс и окисляемость для исходной и очищенной питьевой воды
Перманганатный индекс и окисляемость для исходной и очищенной питьевой воды
Что такое перманганатный индекс?
Перманганатный индекс — это оценка качества воды, обычно используемая для пресной и очищенной питьевой воды. Он включает определение окисляемости, также известной как потребность в кислороде (O 2 ), с помощью перманганата калия (метод ISO 8467). Это метод, предписанный Директивой 98/83 / EC по питьевой воде Совета Европейского Союза (ЕС). Директива касается качества воды, предназначенной для потребления человеком, обеспечивая ее безопасность и чистоту. Для этого рекомендуется использовать предел окисляемости в 5 мг / л O 2 .
Это метод, предписанный Директивой 98/83 / EC по питьевой воде Совета Европейского Союза (ЕС). Директива касается качества воды, предназначенной для потребления человеком, обеспечивая ее безопасность и чистоту. Для этого рекомендуется использовать предел окисляемости в 5 мг / л O 2 .
Метод ISO включает нагревание образца на кипящей водяной бане с известным количеством перманганата калия и концентрированной серной кислоты в течение фиксированного времени (10 минут). Часть перманганата будет восстановлена окисляемым материалом в образце.Израсходованный перманганат можно определить добавлением избытка раствора оксалата с последующим титрованием перманганатом. Этот метод применяется к воде с концентрацией хлорид-иона менее 300 мг / л, так как он удаляется солями ртути. Образцы с перманганатным индексом более 10 мг / л перед анализом следует разбавить. Нижний предел оптимального диапазона теста составляет 0,5 мг / л, однако его трудно получить на регулярной практике. Общее время анализа 30-45 минут на образец.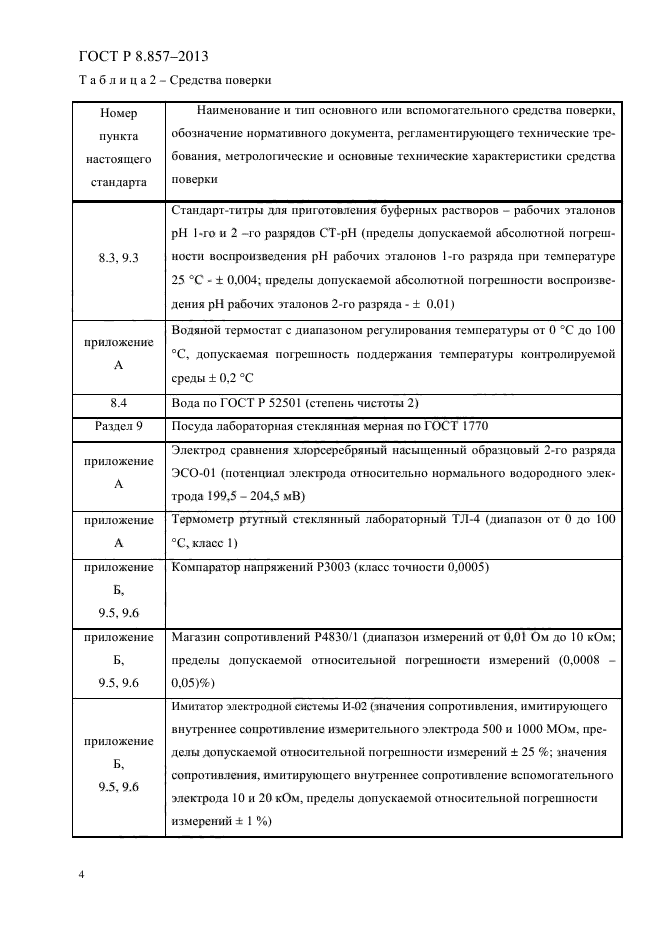 Перманганатный метод не рекомендуется для сточных вод, так как некоторые органические соединения не окисляются (окисляются не полностью).
Перманганатный метод не рекомендуется для сточных вод, так как некоторые органические соединения не окисляются (окисляются не полностью).
Почему измеряется перманганатный индекс?
Предел обнаружения метода (MDL) для Директивы ЕС по питьевой воде ниже, чем MDL для потребности O 2 методом бихромата калия. Кроме того, в ЕС запрещен дихромат калия, так как это известный канцероген, мутаген и репродуктивный токсин. Таким образом, перманганатный метод был выбран Директивой по питьевой воде для измерения требований O 2 (окисляемость).Перманганатный метод также можно использовать для мониторинга исходной воды, чтобы определить уменьшение содержания загрязняющих веществ, необходимое для соблюдения нормативных пределов.
Из-за сложности перманганатного метода некоторые страны разрешили использовать метод общего органического углерода (TOC) в качестве альтернативы. Значения TOC обычно ниже, чем у перманганата, однако они не измеряют реакционную способность (или окисляемость) углерода. В 2017 году производитель ТОС опубликовал в своей брошюре следующее заявление: «Само по себе ТОС не проливает света на окисляемость измеренного углерода или количество кислорода, необходимое для его биоразложения» .Отсутствие измерения правильного параметра может отрицательно повлиять на общественное здоровье и оптимизацию лечения. Министерство здравоохранения Канады осознает преимущества параметра реакционной способности или окисляемости для защиты здоровья населения, однако министерству потребовался новый метод для его поддержки.
В 2017 году производитель ТОС опубликовал в своей брошюре следующее заявление: «Само по себе ТОС не проливает света на окисляемость измеренного углерода или количество кислорода, необходимое для его биоразложения» .Отсутствие измерения правильного параметра может отрицательно повлиять на общественное здоровье и оптимизацию лечения. Министерство здравоохранения Канады осознает преимущества параметра реакционной способности или окисляемости для защиты здоровья населения, однако министерству потребовался новый метод для его поддержки.
Новый метод измерения окисляемости
Метод фотоэлектрохимической потребности в кислороде (peCOD) измеряет окисляемость природных органических веществ (NOM), присутствующих в исходной и очищенной питьевой воде.Он соответствует недавно выпущенному международному методу ASTM D8084 и предлагает простую замену методу перманганатного индекса. Метод peCOD — быстрый, безопасный и экологичный метод, позволяющий операторам анализировать образцы в любом месте. Это исключает период ожидания лаборатории для получения и анализа образцов.
Это исключает период ожидания лаборатории для получения и анализа образцов.
Министерство здравоохранения Канады применяет предел в 5 мг / л для химической потребности в кислороде (ХПК) с помощью метода peCOD в руководящем документе «Природные органические вещества в питьевой воде», который вскоре будет выпущен.Недавнюю презентацию, в которой ХПК рассматривается как параметр для измерения NOM, можно посмотреть здесь. Метод peCOD требует менее 5 минут для подготовки и анализа проб. Он прост в освоении и эксплуатации, что позволяет передать его прямо в руки оператора установки. Технология peCOD доступна в настольной, автоматизированной и онлайн-конфигурациях. Это следующая эволюция обнаружения событий в мониторинге исходной воды, оптимизации коагуляции, потенциала образования побочных продуктов дезинфекции (DBPfp) и соответствия нормативным требованиям.Теперь операторы водоочистки могут иметь этот инструмент в своих руках, что дает им возможность получать быстрые и надежные результаты в любое время.
Перманганат калия, мощный и очень полезный окислитель
Описание
Перманганат калия — фиолетовое кристаллическое твердое вещество с бронзовым оттенком. Он содержит марганец в степени окисления +7. Это мощный окислитель, и загрязнение твердого тела органическими и горючими веществами может привести к самовозгоранию или даже взрыву.Не говоря уже о том, что это химическое вещество токсично и едко для тканей человека. Он оставляет на коже темно-коричневые пятна, которые трудно удалить. При проведении реакций с участием перманганата калия необходимо проявлять особую осторожность.
Перманганат калия — это неорганическая ионная соль, растворимая в воде. Растворимость зависит от температуры. Попытки очистить это соединение путем кристаллизации из воды не должны нагреваться выше 60 градусов по Цельсию. Выше этой температуры соль может разлагаться.Ниже для справки приведена таблица с растворимостью в воде от 0ºC, 30ºC и 60ºC.
Ниже приводится список содержания оставшейся части этой статьи. В этой статье будут рассмотрены некоторые ключевые химические свойства перманганта калия.
В этой статье будут рассмотрены некоторые ключевые химические свойства перманганта калия.
- Растворимость перманганата калия
- Предупреждение о безопасности
- Реакция перманганата калия и глицерина
- Окисление галогенидов
- Генератор хлора на перманганате
- Удаление железа из воды
- Антисептик и стерилизатор
- Пермангант Минерал Хамелеон
- Хамелеон с изменением цвета
- Реагент в органическом синтезе
- Пермангант калия горит!
Безопасность прежде всего!
Хотя перманганат калия — красочное и полезное химическое вещество, при неправильном использовании он может быть очень опасным.Перманганат калия — мощный и нестабильный окислитель. Он также токсичен и едок для тканей человека.
Окислительные свойства перманганата калия представляют особую опасность реакционной способности. Многие химические продукты взаимодействуют с перманганатом калия с образованием токсичных газов, большого количества тепла и даже пожаров и взрывов. С галогеновыми кислотами, такими как соляная и бромистоводородная кислоты, образуются токсичные и коррозионные хлор и бром. Смеси перманганата калия с глицерином и другими гликолями вызывают цепную реакцию, которая приводит к самовозгоранию.Это называется гиперголической реакцией. Перманганат калия является едким веществом, обжигает кожу и оставляет на ней коричневатые пятна. Это вещество необходимо любой ценой держать подальше от глаз.
С галогеновыми кислотами, такими как соляная и бромистоводородная кислоты, образуются токсичные и коррозионные хлор и бром. Смеси перманганата калия с глицерином и другими гликолями вызывают цепную реакцию, которая приводит к самовозгоранию.Это называется гиперголической реакцией. Перманганат калия является едким веществом, обжигает кожу и оставляет на ней коричневатые пятна. Это вещество необходимо любой ценой держать подальше от глаз.
Надлежащая защитная экипировка включает перчатки, химические очки или маску для лица и фартук для защиты одежды. Перманганат калия следует хранить вдали от источников возгорания и горючих материалов. Сюда также входят материалы, не считающиеся горючими, но образующие гиперголические смеси, такие как глицерин, тормозная жидкость или другие продукты, которые могут быть на основе гликоля.
Окисление галогенидов
При подкислении перманганат калия окисляет хлорид, бромид и йодид до свободного галогена и восстанавливает марганец до степени окисления +2. Когда соляная кислота является подкислителем, выделяется большое количество газообразного хлора. Другой полезной реакцией является подкисление раствора перманганата калия разбавленной серной кислотой с последующим добавлением бромида, такого как бромид калия. Освобождается свободный элемент бром.
Когда соляная кислота является подкислителем, выделяется большое количество газообразного хлора. Другой полезной реакцией является подкисление раствора перманганата калия разбавленной серной кислотой с последующим добавлением бромида, такого как бромид калия. Освобождается свободный элемент бром.
Удаление железа из воды
Перманганат калия очень полезен для окисления растворенного железа в воде, превращая его в нерастворимый оксид железа, который легко удаляется фильтрацией.Это улучшает вкус питьевой воды.
Антисептик и стерилизатор
Окислительные свойства перманганата делают его полезным антисептиком. Он используется для лечения различных кожных заболеваний, например, стопы спортсменов. Это также полезно для стерилизации поверхностей, используемых при приготовлении пищи, чтобы предотвратить распространение холеры. Это же свойство делает перманганат калия популярным среди выживших и энтузиастов активного отдыха для очистки воды путем уничтожения вредных микробов.![]()
Перманганат Минерал-хамелеон
Перманганат калия — это химическое соединение переходного металла, называемого марганцем.Переходный металл — это просто причудливый технический способ сказать, что элемент может связываться с различными пропорциями других элементов за счет изменения электрического заряда. Это достигается либо окислением, либо восстановлением. Перманганат калия, как и многие другие соединения переходных металлов, имеет интенсивную окраску. Марганец имеет различные состояния заряда, и большинство из них ярко окрашены. На видео показано удивительное изменение цвета, когда раствор перманганата калия добавляется к перемешиваемому раствору гидроксида натрия (щелочь) и сахарозы (столовый сахар).
Реагент в органическом синтезе
Разбавленный раствор перманганата калия может превращать алкен (углеводороды с двойными связями) в гликоли, которые обесцвечивают розовый раствор. Эта реакция также используется в аналитической химии для определения наличия двойных связей в образце.
При подкислении перманганат расщепляет двойную связь с образованием карбоновых кислот.
CH 3 (CH 2 ) 17 CH = CH 2 + 2 KMnO 4 + 3 H 2 SO 4 → CH 3 (CH 2 ) 17 COOH + CO 2 + 4 H 2 O + K 2 SO 4 + 2 MnSO 4
Пермангант калия также полезен для окисления спиртов и альдегидов в соответствующие карбоновые кислоты.Окисляются ароматические углеводороды с боковыми цепями, такие как толуол. Толуол превращается в бензойную кислоту.
Перманганат очень реактивен по отношению к гликолям и углеводам. Когда небольшая кучка перманганата увлажняется глицерином, после небольшой задержки происходит самопроизвольное сильное возгорание. Это пример того, что называется гиперболической реакцией. Это реакция, при которой горение происходит просто в результате смешения двух компонентов без добавления внешнего источника тепла.
Перманганат калия
Как уже упоминалось, перманганат калия вступает в самоподдерживающуюся пиротехническую реакцию с глицерином при простом перемешивании и ожидании.Это свойство также характерно для других полигликолей, таких как этиленгликоли и пропиленгликоли. Реакция с простыми спиртами идет еще быстрее и может представлять опасность взрыва. Следует отметить, что следует избегать чувствительных и непредсказуемых смесей с серой, фосфором и порошками металлов. Если упомянутые выше порошковые смеси изготовлены, то, конечно, их нельзя хранить в течение длительного времени, так как они могут самовоспламеняться!
алкенов и манганат калия (VII) (перманганат)
Если продукт содержит одну углеводородную группу и один водород
Например, предположим, что первая стадия реакции была:
В этом случае первая молекула продукта имеет метильную группу и водород, присоединенный к
карбонильная группа. Это другой вид соединения, известный как альдегид.
Это другой вид соединения, известный как альдегид.
Альдегиды легко окисляются с образованием карбоновых кислот, содержащих группу -COOH. Итак, на этот раз реакция пойдет на следующую стадию, чтобы получить этановую кислоту, CH 3 COOH.
Кислотная структура была немного изменена, чтобы она больше походила на то, как мы обычно извлекаем кислоты, но в итоге кислород оказался между углеродом и водородом.
Таким образом, общий эффект манганата калия (VII) на этот вид алкенов составляет:
Очевидно, если бы к обоим атомам углерода на концах двойной связи углерод-углерод был присоединен атом водорода, вы бы получили две молекулы карбоновой кислоты, которые могли бы быть одинаковыми или разными, в зависимости от того, были ли одинаковые алкильные группы. или другое.
Поиграйте с этим, пока не будете довольны. Нарисуйте несколько алкенов, каждый из которых имеет водород, присоединенный к обоим концам двойной углерод-углеродной связи. Меняйте алкильные группы — иногда одинаковые на каждом конце двойной связи, иногда разные. Окислите их, чтобы образовались кислоты, и посмотрите, что у вас получится.
Меняйте алкильные группы — иногда одинаковые на каждом конце двойной связи, иногда разные. Окислите их, чтобы образовались кислоты, и посмотрите, что у вас получится.
Если продукт содержит два атома водорода, но не содержит углеводородной группы
Вы, возможно, ожидали, что это приведет к образованию метановой кислоты, как в уравнении:
Но это не так! Это потому, что метановая кислота также легко окисляется раствором манганата калия (VII).Фактически, он полностью окисляет его до двуокиси углерода и воды.
Таким образом, уравнение в таком случае могло бы быть, например:
Точная природа другого продукта (в данном примере пропанона) будет варьироваться в зависимости от того, что было присоединено к правому атому углерода в двойной связи углерод-углерод.
Если бы на обоих концах двойной связи было по два атома водорода (другими словами, если бы у вас был этен), то все, что вы получили бы, — это диоксид углерода и вода.
Сводка
Подумайте о обоих концах двойной связи углерод-углерод по отдельности, а затем объедините результаты.
Если на одном конце связи есть две алкильные группы, эта часть молекулы даст кетон.
Если есть одна алкильная группа и один водород на одном конце связи, эта часть молекулы даст карбоновую кислоту.
Если на одном конце связи есть два атома водорода, эта часть молекулы даст диоксид углерода и воду.
В чем смысл всего этого?
Работа с результатами поможет вам определить структуру алкена. Например, алкен C 4 H 8 имеет три структурных изомера:
Определите, какие из них дали бы каждый из следующих результатов, если бы их обрабатывали горячим концентрированным раствором манганата калия (VII). Вышеуказанные изомеры — это , а не в порядке A, B и C.
Не читайте ответы в зеленой рамке, пока не попробуете это.
Изомер A дает кетон (пропанон) и диоксид углерода.
Изомер B дает карбоновую кислоту (пропановую кислоту) и диоксид углерода.
Изомер C дает карбоновую кислоту (этановую кислоту).
Перманганат калия — Простая английская Википедия, бесплатная энциклопедия
Перманганат калия — неорганическое химическое соединение.Его химическая формула — KMnO 4 . Он содержит ионы калия и перманганата. Марганец находится в степени окисления +7. Он также известен как перманганат калия и кристаллы Конди . Перманганат калия — сильный окислитель, что означает, что он имеет тенденцию забирать электроны у других химических веществ. Он растворяется в воде с образованием пурпурных растворов. Если он испаряется, он образует фиолетово-черные блестящие кристаллы. [2] Обладает сладким вкусом и не имеет запаха. [1]
В 1659 году немецкий химик Иоганн Рудольф Глаубер расплавил смесь минерального пиролюзита и карбоната калия, чтобы получить материал, который при растворении в воде превращался в зеленый раствор (манганат калия).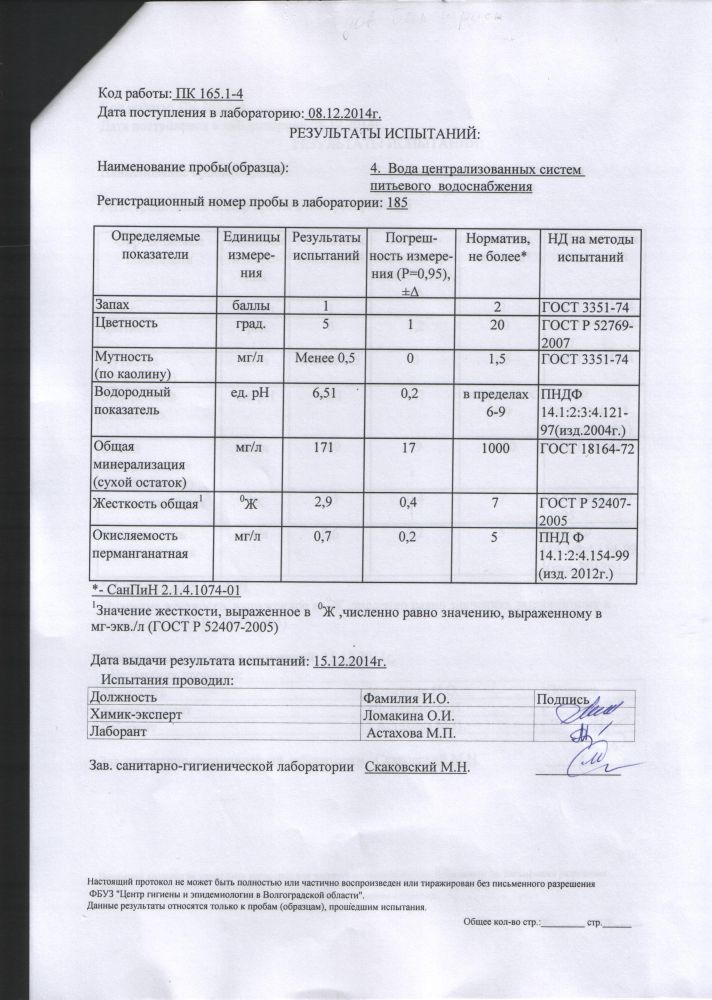 Он медленно менял цвет на фиолетовый (перманганат калия , ), а затем, наконец, на красный. Этот отчет является первым описанием производства перманганата калия.
Он медленно менял цвет на фиолетовый (перманганат калия , ), а затем, наконец, на красный. Этот отчет является первым описанием производства перманганата калия.
Чуть менее 200 лет спустя лондонец по имени Генри Боллманн Конди стал химиком.Он интересовался дезинфицирующими средствами и делал такие вещи, как озонированная вода . Он обнаружил, что когда он расплавил пиролюзит с гидроксидом натрия и растворил его в воде, получился раствор, обладающий хорошими дезинфицирующими свойствами. Он запатентовал это решение и продал его как Condy’s Fluid . Проблема заключалась в том, что решение было не очень стабильным. Это было исправлено с помощью гидроксида калия, а не гидроксида натрия. Это дало более стабильный материал. Его также можно было высушить до такого же хорошего порошка перманганата калия.Этот порошок назывался кристаллы Конди или порошок Конди . Перманганат калия было легко сделать, поэтому Конди пытался помешать другим людям производить его и продавать сам.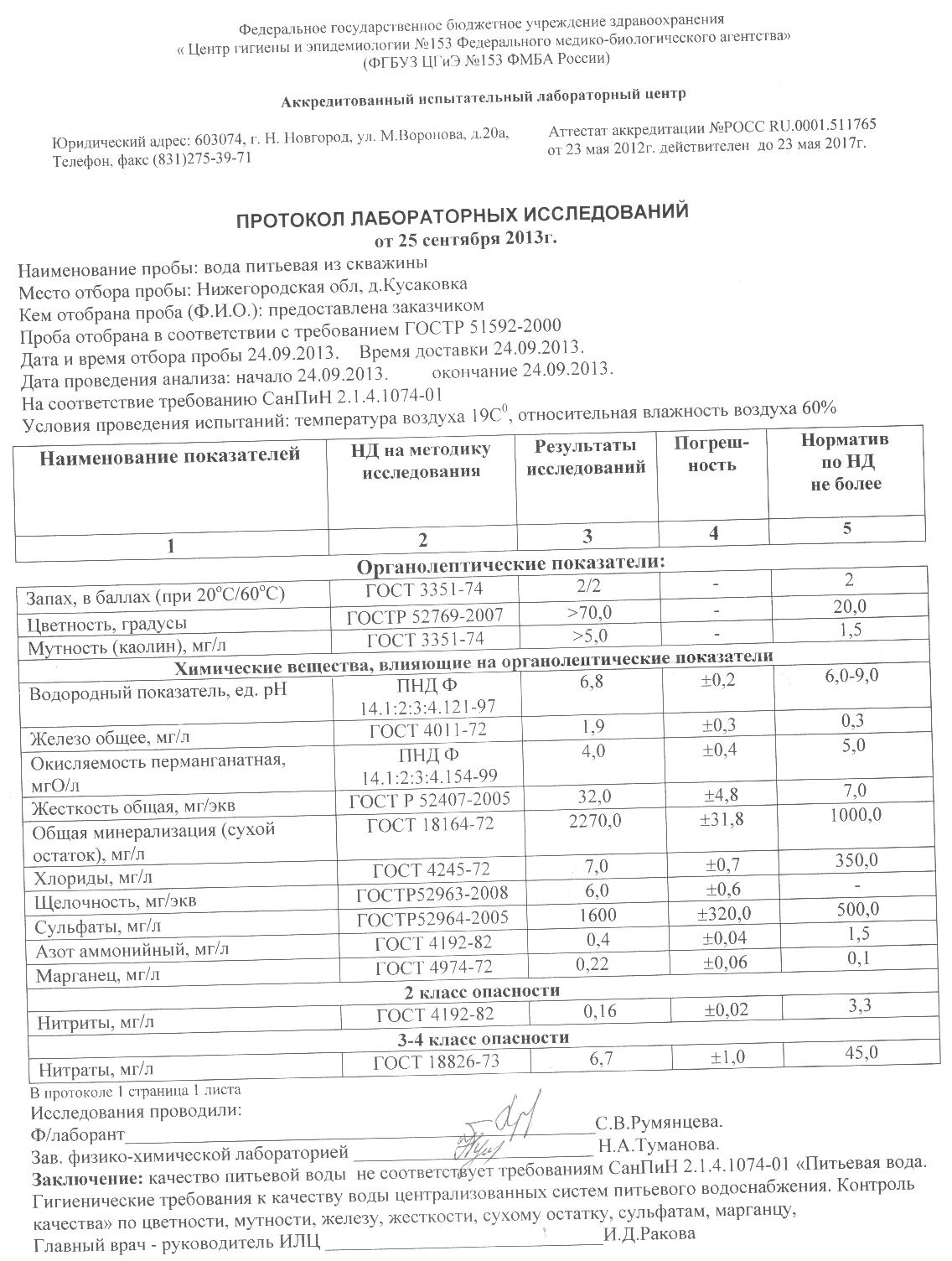
Ранние фотографы использовали его в порошковой вспышке.
Применение в химической промышленности [изменить | изменить источник]
Перманганат калия используется как окислитель. [3] Он также используется в дезинфицирующих средствах и дезодорантах. Его можно использовать для производства самых разных химикатов.При очистке сточных вод он используется для избавления от сероводорода, вонючего токсичного газа. В аналитической химии иногда используется точная концентрация KMnO 4 , чтобы увидеть, сколько определенного восстановителя присутствует при титровании. Похожим образом он используется как реагент для древесной массы. При смешивании перманганата калия и формальдегида образуется слабый слезоточивый газ.
В качестве окислителя в органическом синтезе [изменить | изменить источник]
Разбавленные растворы KMnO 4 превращают алкены в диолы (гликоли).Это поведение также используется в качестве качественного теста на наличие двойных или тройных связей в молекуле, поскольку реакция делает раствор перманганата бесцветным. Иногда его называют реактивом Байера.
Иногда его называют реактивом Байера.
Концентрированные растворы окисляют метильную группу ароматического кольца, например толуол в бензойную кислоту.
KMnO 4 окисляет гидрохлорид псевдоэфедрина с образованием меткатинона, препарата Списка I. Следовательно, DEA ограничило его использование и продажу, классифицировав его как прекурсор, контролируемый Списком I.Перманганат калия включен в список прекурсоров Таблицы I в соответствии с Конвенцией Организации Объединенных Наций о борьбе с незаконным оборотом наркотических средств и психотропных веществ. [2]
Кислоты и перманганат калия [изменить | изменить источник]
Концентрированная серная кислота реагирует с перманганатом калия с образованием оксида марганца (VII), который может быть взрывоопасным. [4] [5] [6] . В этой реакции также образуется озон. Озон может воспламенить бумагу, пропитанную спиртом.Эта реакция очень опасна.
- 6 KMnO 4 + 9 H 2 SO 4 → 6 MnSO 4 + 3 K 2 SO 4 + 9 H 2 O + 5 O 3
Концентрированный HCl образует хлор.
- 2 KMnO 4 + 16 HCl → 2 MnCl 2 + 2 KCl + 8 H 2 O + 5 Cl 2
Mn-содержащие продукты окислительно-восстановительных реакций зависят от pH. Кислые растворы перманганата восстанавливаются до бледно-розового иона Mn 2+ , как в хлориде марганца (II).В нейтральном растворе перманганат восстанавливается до коричневого оксида марганца (IV), где Mn находится в степени окисления +4. Оксид марганца (IV) — это вещество, которое окрашивает кожу при нанесении на нее перманганата калия. Перманганат калия самопроизвольно восстанавливается в щелочном растворе до манганата калия зеленого цвета, где марганец находится в степени окисления +6.
Биомедицинское использование [изменить | изменить источник]
- Разбавленные растворы используются для лечения язвы (язвы) (0.25%), дезинфицирующее средство для рук (около 1%) и средство для лечения мягкого дерматита помфоликс или грибковых инфекций рук или ног.

- Разбавленный раствор подкисленного перманганата калия используется в гистологии для отбеливания меланина, который затемняет детали тканей.
- Перманганат калия можно использовать для дифференциации амилоидного АК от других типов амилоида, патологически откладываемых в тканях организма. Инкубация фиксированной ткани с перманганатом калия предотвратит окрашивание амилоида АК конго красным, в то время как другие типы амилоида не затронуты. [7] [8]
Разное [изменение | изменить источник]
Растворенный перманганат калия- Растворы KMnO 4 использовались вместе с 80% перекисью водорода для приведения в движение ракеты. В этом случае он получил название Z-Stoff. Этот порох до сих пор используется в торпедах.
- Разбавленный (10 мг / л) перманганат калия можно использовать для удаления улиток с растений перед помещением их в пресноводный аквариум.
- Высококачественный перманганат калия можно найти в магазинах товаров для бассейнов и используется в сельской местности для удаления железа и сероводорода (запах тухлых яиц) из колодезной воды.

- KMnO 4 часто входит в наборы для выживания вместе с глицерином или таблеткой глюкозы для разведения огня. Таблетку глюкозы можно измельчить, смешать с перманганатом калия, и она загорится, если потереть. Его также можно смешать с антифризом из автомобиля, чтобы развести огонь. Это может быть опасно и должно выполняться осторожно, окунув немного бумаги в антифриз, а затем добавив небольшое количество перманганата калия. Он также может стерилизовать воду и раны, поэтому его можно использовать в комплекте для выживания.
- KMnO 4 применяется для лечения некоторых паразитарных болезней рыб, для очистки питьевой воды, а также как противоядие при отравлении фосфором. В Африке он использовался как дезинфицирующее средство для овощей, таких как салат.
Твердый перманганат калия является сильным окислителем, поэтому его следует хранить отдельно от восстановителей. Для некоторых реакций требуется немного воды. Например, перманганат калия и сахарная пудра воспламенится (но не взорвутся) через несколько секунд после добавления капли воды. Райт-младший, Калкинс Э., Хамфри Р.Л. Лабораторное исследование . 1977 мар; 36 (3): 274-81. PMID 839739
Райт-младший, Калкинс Э., Хамфри Р.Л. Лабораторное исследование . 1977 мар; 36 (3): 274-81. PMID 839739
ОКИСЛЕНИЕ-ВОССТАНОВЛЕНИЕ ТИТРАЦИИ-Перманганометрия — Скачать PDF бесплатно
ТИТРАЦИЯ ВИТАМИНА С
ТИТРОВАНИЕ ВИТАМИНА С Введение: в этой лаборатории мы будем выполнять два разных типа титрования аскорбиновой кислоты, более известной как витамин С.Первым будет кислотно-основное титрование в
Дополнительная информацияДополнительная лекция: ОСНОВЫ ТИТРАЦИИ
Дополнительная лекция: ОСНОВЫ ТИТРАЦИИ 1 Определение и применение Титрование — это постепенное добавление раствора реагента (называемого титрантом) к аналиту до завершения реакции. Общие приложения:
Общие приложения:
Анализ кальция титрованием ЭДТА
Анализ кальция с помощью ЭДТА-титрования Одним из факторов, определяющих качество воды, является ее степень жесткости.Жесткость воды определяется содержанием в ней кальция и магния
Дополнительная информацияНеполярная углеводородная цепь
НАУКА О МЫЛЕ И МОЮЩИХ СРЕДСТВАХ 2000 Дэвид А. Кац. Все права защищены. Воспроизведение разрешено в образовательных целях при условии сохранения авторских прав. ВВЕДЕНИЕ Мыло — это соль
Дополнительная информацияРазложение.Сочинение
Разложение 1. Твердый карбонат аммония нагревают. 2. Твердый карбонат кальция нагревают. 3. Твердый сульфит кальция нагревают в вакууме. Состав 1. Оксид бария добавлен в дистиллированную воду. 2. Фосфор
2. Фосфор
CHM1 Отзыв к экзамену 12
Темы Решения 1. Аррениусовы кислоты и основания a. Кислота увеличивает концентрацию H + в b.Основание увеличивает концентрацию ОН — в 2. Сильные кислоты и основания полностью диссоциируют 3. Слабые кислоты и
Дополнительная информацияСвойства кислот и оснований
Лабораторная работа 22 Свойства кислот и оснований TN Standard 4.2: Студент исследует характеристики кислот и оснований. Вы когда-нибудь чистили зубы, а затем выпивали стакан апельсинового сока? Что
Дополнительная информацияХимический колледж Санта-Моники 11
Типы реакций Цели Цели этой лаборатории заключаются в следующем: Проведение и наблюдение за результатами различных химических реакций.Ознакомиться с наблюдаемыми признаками химического вещества
Дополнительная информацияКомплексометрические титрования
Комплексометрическое титрование Комплексометрическое титрование основано на образовании растворимого комплекса при реакции веществ, титруемых титрантом. M + L ML В модуле Химия 2 вы были
M + L ML В модуле Химия 2 вы были
Эмпирическая формула соединения
Эмпирическая формула лаборатории соединений № 5 Введение Взгляд на массовые отношения в химии обнаруживает мало порядка или смысла.Отношение масс элементов в соединении, пока постоянное,
Дополнительная информацияЭксперимент 16-кислоты, основания и ph
Определения кислота — ионное соединение, которое выделяет воду или вступает с ней в реакцию с образованием иона водорода (H +) в водном растворе. Они кислые на вкус и становятся красной лакмусовой бумажкой. Кислоты реагируют с некоторыми металлами, такими как цинк,
Дополнительная информацияПрактическое занятие № 4 ТИТРАЦИИ
Практическое занятие №4 ТИТРОВАНИЕ Реагенты: 1.Стандартный раствор NaOH 0,1 моль / л 2. Раствор H 2 SO 4 неизвестной концентрации 3. Фенолфталеин 4. Стандартный раствор Na 2 S 2 O 3 0,1 моль / л 5. Раствор крахмала
Раствор H 2 SO 4 неизвестной концентрации 3. Фенолфталеин 4. Стандартный раствор Na 2 S 2 O 3 0,1 моль / л 5. Раствор крахмала
Химия: химические уравнения
Химия: химические уравнения Напишите сбалансированное химическое уравнение для каждого словесного уравнения. Включите в уравнение фазу каждого вещества. Классифицировать реакцию как синтез, разложение, однократное замещение,
Дополнительная информацияIB Химия.Обзор химии DP
DP Chemistry Review Тема 1: Количественная химия 1.1 Концепция молей и константа Авогадро Заявление об оценке Примените концепцию молей к веществам. Определить количество частиц и количество
Дополнительная информацияНейтрализация кислоты и основания
Balancing Act Информация для учителя Задачи В этом упражнении учащиеся нейтрализуют щелочь с помощью кислоты. Учащиеся определяют точку нейтрализации кислоты, смешанной с основанием, пока они: Узнают
Учащиеся определяют точку нейтрализации кислоты, смешанной с основанием, пока они: Узнают
ph: Измерение и использование
ph: Измерение и использование Одним из наиболее важных свойств водных растворов является концентрация иона водорода. Концентрация H + (или H 3 O +) влияет на растворимость неорганических и органических веществ
Дополнительная информацияСмеси и чистые вещества
Блок 2 Смеси и чистые вещества Вещества можно разделить на две группы: смеси и чистые вещества.Смеси являются наиболее распространенной формой веществ и состоят из смесей чистых веществ. Они
Дополнительная информацияРазделение экстракцией растворителем
Эксперимент 3 Разделение с помощью экстракции растворителем Цели Разделить смесь, состоящую из карбоновой кислоты и нейтрального соединения, с использованием методов экстракции растворителем. Введение Часто органические
Введение Часто органические
Обзор стехиометрии
Обзор стехиометрии В этом обзоре 20 задач.Ответы, включая постановку задачи, можно найти во второй половине этого документа. 1. N 2 (г) + 3H 2 (г) ———> 2NH 3 (г) а. азот
Дополнительная информацияW1 МАСТЕРСКАЯ ПО СТОХИОМЕТРИИ
ВВЕДЕНИЕ W1 СЕМИНАР ПО СТОХИОМЕТРИИ Эти заметки и упражнения разработаны, чтобы познакомить вас с основными понятиями, необходимыми для понимания химической формулы или уравнения. Относительные атомные массы
Дополнительная информация1 из 8 10.05.2010 00:47
1 of 8 5/10/2010 12:47 AM All, Кажется, существует большая путаница по поводу различных смесей кислот, используемых в различных реакциях.Я составил этот быстрый список смесей реакций. Я знаю неполный
Дополнительная информацияМолярность ионов в растворе.
ПРИЛОЖЕНИЕ A. Молярность ионов в растворе. Часто необходимо рассчитать не только концентрацию (в молярности) соединения в водном растворе, но также и концентрацию каждого иона в водном растворе.
Дополнительная информацияFAJANS ОПРЕДЕЛЕНИЕ ХЛОРИДА
ЭКСПЕРИМЕНТ 3 FAJANS ОПРЕДЕЛЕНИЕ ХЛОРИДА Хлорид серебра очень нерастворим в воде.Добавление AgNO 3 к раствору, содержащему ионы хлорида, приводит к образованию мелкодисперсного белого осадка
Дополнительная информация10+ GOST WATER TOP поставщики из 🇷🇺 России, Казахстана [2021]
Экспорт воды ГОСТ:
- Азербайджан
- Болгария
- Греция
- Казахстан
- Кыргызстан
- Латвия
- Молдова
- Монголия
- Россия
- Судан
- Таджикистан
- ТУРКМЕНИСТАН
- Турция
- Узбекистан
- Украина
менеджер по логистике в ЕС, Азию
логистика, сертификат
электронная почта: [электронная почта защищена]
Российский ГОСТ водный продукт
🇷🇺 ТОП-экспортер ГОСТ воды из РФ
ГОСТ компании-производителя воды эту продукцию много покупают:
Поставщик
Товар из России
Котлы водогрейные типа КВ теплопроизводительностью 0.2; 0,3; 0,5 МВт, с температурой воды на выходе до 95 ° С. Топливо — уголь, бурый уголь по ГОСТ 32464-2013, древесные отходы по ГОСТ Р 56
.Элементы оборудования (сборочные единицы) и комплектующие к нему, выдерживающие давление для трубопроводов пара, горячей воды, газа и нефтепродуктов: Фланцы стальные ГОСТ 33259-2015, ГОСТ 12820-80, ГОСТ 12821-80
Водогрейные котлы типа КВА-Гн теплопроизводительностью 0.От 1 до 9,28 МВт и температуре воды на выходе до 110 ° С. Топливо — природный газ по ГОСТ 5542-2014.
Водогрейные котлы типа КВА теплопроизводительностью 0.От 1 до 4,0 МВт, при температуре воды на выходе до 110 ° С. Топливо — природный газ по ГОСТ 5542-2014.
Водогрейные котлы типа КБа теплопроизводительностью 0.От 4 до 5,0 МВт и температуре воды на выходе до 110 ° С. Топливо — природный газ по ГОСТ 5542-2014.
Водогрейные котлы типов КВА-ГН, КВА-ЛЖ, КВА-М (ТЕМРОН-ВЛ) тепловой мощностью от 0,1 до 6,0 МВт, с температурой воды на выходе до 110 ° С … Топливо — природное газ по ГОСТ 5542-2014, фильеры
Водогрейные котлы КВ-Р (Т; Ж; Ц; Ф; В; М; ГМ) -4,65 (5,0; 7,0; 7,56; 10,0; 11,63; 17,5; 23,26; 29,0; 35,0) -110, с отводом воды температура до 110 ° С.Топливо — каменный уголь, бурый уголь по ГОСТ Р 51591-2
.









