43.Электролиз. Законы электролиза
Электролиз — физико-химический процесс, состоящий в выделении на электродах составных частей растворённых веществ или других веществ, являющихся результатом вторичных реакций на электродах, который возникает при прохождении электрического тока через раствор, либо расплавэлектролита.
Упорядоченное движение ионов в проводящих жидкостях происходит в электрическом поле, которое создается электродами — проводниками, соединёнными с полюсами источника электрической энергии. Анодом при электролизе называется положительный электрод, катодом — отрицательный[1]. Положительные ионы — катионы — (ионы металлов, водородные ионы, ионы аммония и др.) — движутся к катоду, отрицательныеионы — анионы — (ионы кислотных остатков и гидроксильной группы) — движутся к аноду.
Явление
электролиза широко применяется в
современной промышленности.
В частности, электролиз является одним
из способов промышленного
получения алюминия, водорода,
а также гидроксида
натрия, хлора,
хлорорганических
соединений
Электролиз находит применение в очистке сточных вод (процессы электрокоагуляции, электроэкстракции, электрофлотации). Применяется для получения многих веществ (металлов, водорода, хлора и др.), при нанесении металлических покрытий (гальваностегия), воспроизведении формы предметов (гальванопластика).
Первый закон Фарадея
Первый закон электролиза Фарадея: масса вещества, осаждённого на электроде при электролизе, прямо пропорциональна количеству электричества, переданного на этот электрод. Под количеством электричества имеется в виду электрический заряд, измеряемый, как правило, в кулонах.
В 1832 году Фарадей установил, что масса m вещества, выделившегося на электроде, прямо пропорциональна электрическому заряду q, прошедшему через электролит: если через электролит пропускается в течение времени t постоянный ток с силой тока I. Коэффициент пропорциональности называется электрохимическим эквивалентом вещества. Он численно равен массе вещества, выделившегося при прохождении через электролит единичного электрического заряда, и зависит от химической природы вещества.
Вывод закона Фарадея
(1)
(2)
(3)
(4)
, где z — валентность атома (иона) вещества, e — заряд электрона (5)
Подставляя (2)-(5) в (1), получим
где — постоянная Фарадея.
Второй закон Фарадея
Второй закон электролиза Фарадея: для данного количества электричества масса химического элемента, осаждённого на электроде, прямо пропорциональна эквивалентной массе элемента. Эквивалентной массой вещества является его молярная масса, делённая на целое число, зависящее от химической реакции, в которой участвует вещество.
Электрохимические эквиваленты различных веществ относятся, как их химические эквиваленты.
Химическим эквивалентом иона называется отношение молярной массы A иона к его валентности z. Поэтому электрохимический эквивалент
где — постоянная Фарадея.
Второй закон Фарадея записывается в следующем виде:
где — молярная масса данного вещества, образовавшегося (однако не обязательно выделившегося — оно могло и вступить в какую-либо реакцию сразу после образования) в результате электролиза, г/моль; — сила тока, пропущенного через вещество или смесь веществ (раствор, расплав), А; — время, в течение которого проводился электролиз, с; — постоянная Фарадея,Кл·моль −1; — число участвующих в процессе электронов, которое при достаточно больших значениях силы тока равно абсолютной величине заряда иона (и его противоиона), принявшего непосредственное участие в электролизе (окисленного или восстановленного). Однако это не всегда так; например, при электролизе раствора соли меди(II) может образовываться не только свободная медь, но и ионы меди(I) (при небольшой силе тока).
studfiles.net
Законы электролиза Фарадея и их применение для расчета количественных характеристик процесса электролиза
Электролизомназывается совокупность электрохимических окислительно-восстановительных реакций, протекающих на электродах при прохождении постоянного электрического тока через раствор или расплав электролита. При этом на катоде происходит процесс
Fe3+ + e – → Fe2+ ; (3.54)
Cu2+ + 2 e – → Cu. (3.55)
Нейтральные молекулы могут участвовать в превращениях на катоде непосредственно или взаимодействовать с продуктами катодного процесса, которые рассматриваются в этом случае как промежуточные вещества. Например, восстановление воды:
2 H2O + 2 e – → H2 + 2 OH–. (3.56)
На аноде окисляются ионы или молекулы, поступающие из объема электролита, например:
4 OH– – 4 e – → 2 H2O + H2; (3.57)
2 Cl– – 2 e – → Cl2,– (3.58)
или принадлежащие материалу анода. в последнем случае анод растворяется, например:
Cu – 2 e – → Cu2+ (растворение медного анода). (3.59)
Протекание электродных реакций зависит от состава и концентрации электролита, материала электродов, электродного потенциала, температуры, гидродинамических условий.
Процессы электролиза описываются законами Фарадея, которые в объединенной форме читаются следующим образом: массы веществ, испытавших электрохимические превращения на электродах, прямо пропорциональны количеству протекшего через электролит электричества и электрохимическим эквивалентам этих веществ:
 (3.60)
(3.60)
где m – масса вещества, превратившегося на электроде (выделившегося на электроде),
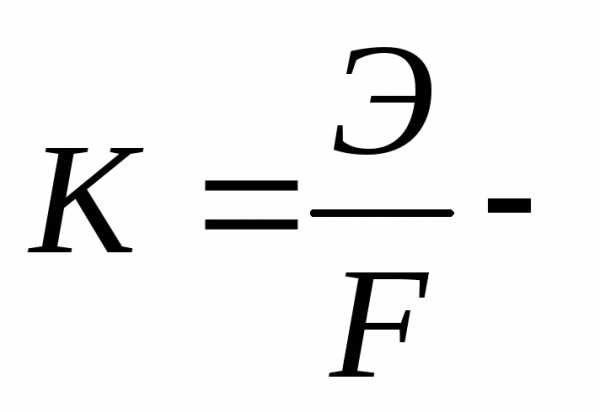 электрохимический
эквивалент – величина характеризующая массу
продуктов электролиза, выделившихся
на электродах при прохождении через
электролит 1 Кл электричества;
электрохимический
эквивалент – величина характеризующая массу
продуктов электролиза, выделившихся
на электродах при прохождении через
электролит 1 Кл электричества;
Э – химический эквивалент вещества (эквивалентная масса вещества) при окислительно-восстановительном превращении, г/экв;
q – количество прошедшего электричества, Кл;
F – число Фарадея (96485 Кл/г-экв) – количество электричества, необходимое для химического превращения (выделения на электроде) 1 г-экв вещества.
Так как q = I · τ (I – сила тока, А; τ – продолжительность электролиза, с), то уравнение закона Фарадея может быть записано следующим образом:
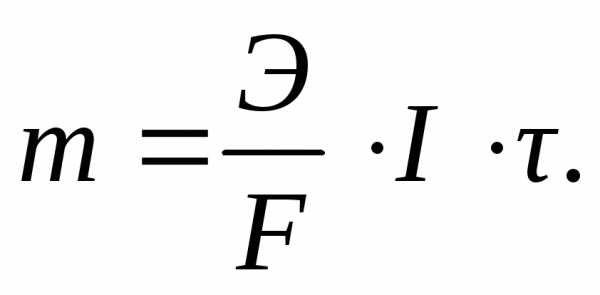 (3.61)
(3.61)
Химический эквивалент вещества (эквивалентная масса вещества) при окислительно-восстановительном превращении рассчитывается по формуле:
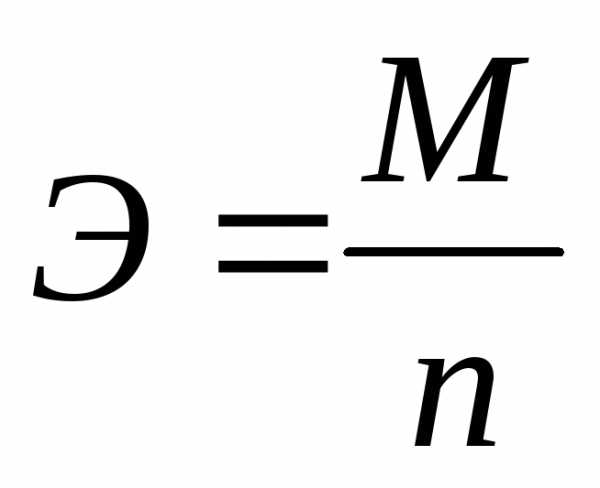 , (3.62)
, (3.62)
где М– молярная масса вещества, претерпевающего превращение на электроде, г/моль;
n– количество электронов, участвующих в одном акте химического превращения.
При электрохимических процессах часто наблюдаются отклонения от законов Фарадея: масса действительно полученного или разложившегося продукта не соответствует теоретической. Эти отклонения – кажущиеся и возникают за счет одновременного протекания побочных электрохимических процессов; химических реакций, в которые вступает продукт; потерь продукта и потерь электроэнергии на преодоление сопротивления электролизера. Эффективность электрохимического процесса оценивается
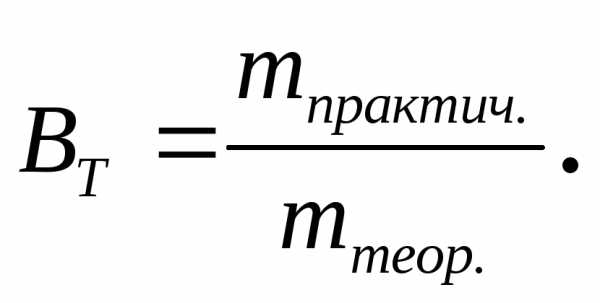 (3.63)
(3.63)
Эта величина может быть выражена в процентах:
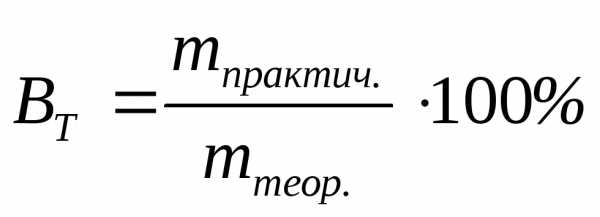 .
(3.64)
.
(3.64)
Тогда практическое количество вещества, образующееся при электролизе рассчитывается по формуле:
. (3.65)
П р и м е р 3.18. Какое количество алюминия выделится при электролизе за время 12 ч, если сила тока I =2,5 A, а выход по току составляет 88 %. Молярная масса алюминия М, равная его грамм-атомной массе А, составляет 26,98 г/моль.
Р е ш е н и е
Выделение алюминия при электролизе происходит на катоде при прохождении следующей реакции восстановления:
Al3+ + 3 e – = Al; n = 3.
Химический эквивалент алюминия рассчитываем по формуле (3.62):
Э = М / 3 = 26,98 / 3 = 8,99 г/экв.
Продолжительность электролиза τ = 12 час = 12 · 3600 = 43200 с.
По объединенному закону Фарадея (3.61) находим теоретическое количество алюминия, выделяющееся при электролизе в указанных условиях:
г.
Практическое количество выделившегося при электролизе алюминия находим с учетом величины ВТ по формуле (3.65):
Р е ш е н и е
На основании формулы (3.64) находим, на какое теоретическое количество меди необходимо рассчитывать продолжительность электролиза:
Выделение меди при электролизе происходит на катоде при прохождении следующей реакции восстановления:
Сu2+ + 2 e– = Cu; n = 2.
Химический эквивалент меди рассчитываем по формуле (3.62):
Э = М / 2 = 63,54 / 2 = 31,77 г/экв.
Из уравнения закона Фарадея (3.61) находим время процесса:
studfiles.net
Законы электролиза
Процессы электролиза подчиняются законам Фарадея:
Первый закон:
Масса электролита, подвергшаяся химическому превращению, а также массы веществ, выделившихся на электродах, прямо пропорциональны количеству электричества, прошедшему через расплав или раствор электролита.
Второй закон:
При пропускании одинакового количества электричества через растворы или расплавы различных электролитов масса веществ, выделяющихся на электродах, пропорциональна их химическим эквивалентам.
Для расчетов используют объединенное уравнение законов Фарадея:
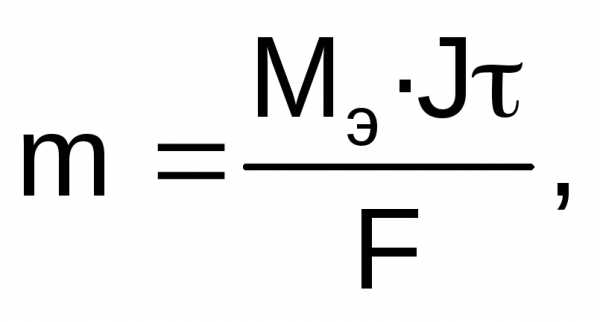
где m – масса электролита, подвергшаяся химическому превращению, или масса вещества, выделившегося на электроде, г; Мэ – молярная масса эквивалентов вещества, г/моль; J – сила тока, А; — время электролиза, с; F – число Фарадея (96500 Кл/моль).
Молярная масса эквивалентов вещества рассчитывается по формуле:
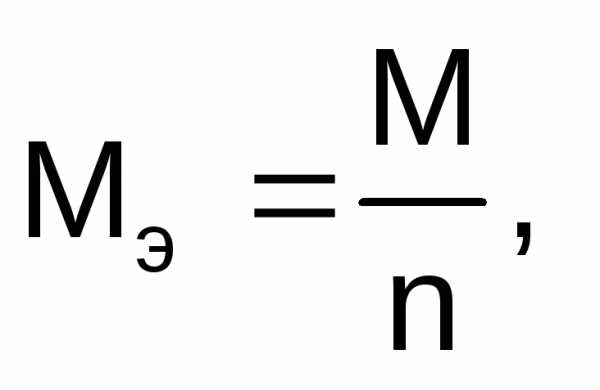
где М – молярная масса вещества, г/моль;
n – число электронов, участвующих в электродном процессе.
Для расчета объемов газообразных продуктов электролиза в законе Фарадея молярная масса эквивалентов вещества Мэ заменяется на молярный объем эквивалента газа при нормальных условиях (Vэ), который рассчитывается по формуле:

где 22,4 – это объем,
который занимает 1 моль любого газа при
нормальных условиях, л; n
– число  ,
отданных или принятых 1 моль газа.
,
отданных или принятых 1 моль газа.
При проведении электролиза в реальных условиях, вследствие побочных процессов масса вещества, выделившегося на электроде, оказывается меньше массы, рассчитанной по закону Фарадея. Отношение массы вещества, полученной при электролизе (mпракт.) к массе вещества, рассчитанной по закону Фарадея (mтеор.), выраженное в процентах, называется выходом по току (Вт):
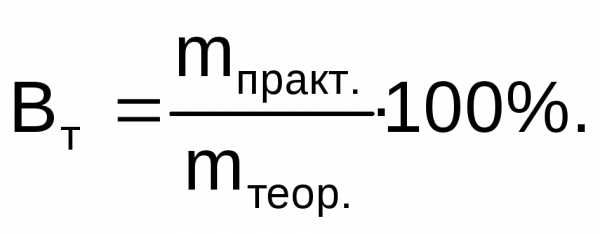
Пример 1. Составьте электронные уравнения электродных процессов, протекающих при электролизе раствора CuSO4. Определите массу меди и объем газа, выделившихся на электродах при прохождении тока силой 5 А в течение 2 часов.
Решение. В водном растворе CuSO4 диссоциирует по схеме
CuSO4 Cu2+ + SO42–
При электролизе раствора соли CuSO4 на катоде будут восстанавливаться ионы Cu2+, а на аноде – окисляться молекулы воды.
Катод
(–):Cu2+ + 2
Cu
2
Cu
2
Анод (+): 2Н2О
— 4
О2 + 4Н+ 1
О2 + 4Н+ 1
Суммарная реакция: 2CuSO4 + 2H2O 2Cu + O2 + 2H2SO4
Молекулы H2SO4 образуются в результате побочной реакции между ионами Н+ и кислотными остатками SO42–, которые накапливаются у поверхности анода.
Масса меди, выделившейся на катоде:
Объем кислорода, выделившегося на аноде:
Ответ: m(Сг)=11,85 г;
Пример 2. Составьте схему электролиза водного раствора соли NaCl и рассчитайте массу образовавшегося на катоде гидроксида натрия, если на аноде выделилось 1,12 л газа.
Решение. В водном растворе NaCl диссоциирует по схеме:
NaCl Na+ + Cl–
При электролизе раствора NaCl на катоде будет восстанавливаться водород из молекул воды, а на аноде – окисляться ионы Cl– до газообразного Cl2:
Катод
(–): 2Н2О
+ 2
Н2 + 2ОН– 1
Н2 + 2ОН– 1
Анод (+): 2Cl– — 2
Cl2 1
Cl2 1
Суммарная реакция: 2NaCl + 2H2O H2 + 2NaOH + Cl2
Молекулы NaОН образуются в результате взаимодействия ионов ОН– с ионами Na+, которые накапливаются у поверхности катода.
Молярный объем эквивалента хлора:
Количество эквивалентов хлора:
Так как на электродах выделяется одинаковое количество эквивалентов веществ, то
nэ(NaOH) = 0,1 моль.
Масса образовавшегося NaOH:
n(NaOH) = Mэ(NaOH)nэ(NaOH) = 40 0,1 = 4 г.
Ответ: 4 г.
Пример 3. Определите массу цинка, который выделится на катоде при электролизе сульфата цинка в течение 1 часа при токе 26,8 А, если выход цинка по току равен 58%. Составьте схему электродных процессов.
Решение. Согласно закону Фарадея масса выделившегося цинка:
С учетом выхода по току практически выделившаяся масса цинка:
Схема электролиза раствораZnSO4:
ZnSO4 Zn2+ + SO42–
К
1
атод (–):Zn2+ + 2
Zn
Zn 2H2O
+ 2
H2 + 2OH–
H2 + 2OH–
Анод
(+): 2H2O
— 4
O2 + 4H+ 1
O2 + 4H+ 1
Cуммарная реакция:
2ZnSO4 + 4H2O Zn + H2 + Zn(OH)2 + O2 + 2H2SO4
Низкий выход по току цинка объясняется тем, что одновременно с цинком на катоде восстанавливаются молекулы воды и часть электричества расходуется на этот процесс.
Ответ: 18,96 г.
studfiles.net
Законы электролиза Фарадея | Физика. Закон, формула, лекция, шпаргалка, шпора, доклад, ГДЗ, решебник, конспект, кратко
В 1833 г. М. Фарадей установил:
Масса вещества, которое выделяется при прохождении электрического тока в электролитах на аноде или катоде, прямо пропорциональна заряду, который при этом переносится ионами через электролит:
m = kq,
где m — масса вещества, кг; q — заряд, Кл.
Коэффициент пропорциональности k = m / q называется электрохимическим эквивалентом данного вещества.
Электрохимический эквивалент вещества показывает, какая масса вещества в килограммах выделяется на электроде при прохождении тока, переносящего заряд, равный одному кулону:
k = m / q
Если иметь в виду, что при постоянном токе в цепи q = IΔt, где I — сила тока (ампер), а Δt — время прохождения тока (секунд), то закон Фарадея можно записать в виде
m = kIΔt.
Исходя из современных представлений, закон для электролиза можно установить теоретически. Пусть за время Δt через электролит переносится заряд q. Заряд одного иона q0i = ne, где n — валентность иона, а e — значение элементарного электрического заряда. Следовательно, q = neNi, где Ni — количество ионов, которые достигли электрода.
С другой стороны, масса вещества, выделяющегося на электроде m = m0iNi, где m0i — масса иона, которая может быть определена по молярной массе вещества M и постоянной Авогадро NA:
m0i = M / NA; m = (M / NA) • Ni.
Из уравнения для заряда q = neNi можно определить Ni: Ni = q / ne. Подставив значения Niв выражение для массы, получаем:
m = (M / neNA) • q,
что также является законом Фарадея для электролиза. Итак, электрохимический эквивалент вещества
k = M / neNA,
где все величины для данного вещества являются постоянными.
В последней формуле значение элементарного заряда e и постоянная Авогадро одинаковы для всех веществ. Их произведение назвали постоянной Фарадея:
F = eNA.
Значение постоянной Фарадея:
F = 1,6 • 10-19 Кл • 6,023 • 1023 моль-1 = -9,65 • 104 Кл/моль.
Теперь для электрохимического эквивалента вещества имеем Материал с сайта http://worldofschool.ru
k = (1 / F) • (M / n),
что и является вторым законом для электролиза.
Второй закон электролиза. Электрохимические эквиваленты веществ прямо пропорциональны массам их молей и обратно пропорциональны их валентностям.
Чтобы удобно было решать многие задачи, оба закона можно объединить в одном выражении (объединенный закон электролиза):
m = (1 / F) • (M / n) • q,
или
m = (1 / F) • (M / n) • IΔt.
На этой странице материал по темам:Формула и формулировка закона фарадея
Обозначение формулы второго закона фарадея
34. закон электролиза формулы
Формула и формулировка законов фарадея для электролиза
Второй закон электролиза фарадея формула
Сформулируйте закон Фарадея для электролиза, запишите его формулу.
Запишите формулы объединенного закона электролиза.
Что такое постоянная Фарадея?
worldofschool.ru
Электрический ток в жидкостях. Закон электролиза
Электрический ток в жидкостях. Закон электролиза
«Физика — 10 класс»
Каковы носители электрического тока в вакууме?
Каков характер их движения?
Жидкости, как и твёрдые тела, могут быть диэлектриками, проводниками и полупроводниками. К диэлектрикам относится дистиллированная вода, к проводникам — растворы и расплавы электролитов: кислот, щелочей и солей. Жидкими полупроводниками являются расплавленный селен, расплавы сульфидов и др.
Электролитическая диссоциация.
При растворении электролитов под влиянием электрического поля полярных молекул воды происходит распад молекул электролитов на ионы.
Распад молекул на ионы под влиянием электрического поля полярных молекул воды называется электролитической диссоциацией.
Степень диссоциации — доля в растворённом веществе молекул, распавшихся на ионы.
Степень диссоциации зависит от температуры, концентрации раствора и электрических свойств растворителя.
С увеличением температуры степень диссоциации возрастает и, следовательно, увеличивается концентрация положительно и отрицательно заряженных ионов.
Ионы разных знаков при встрече могут снова объединиться в нейтральные молекулы.
При неизменных условиях в растворе устанавливается динамическое равновесие, при котором число молекул, распадающихся за секунду на ионы, равно числу пар ионов, которые за то же время вновь объединяются в нейтральные молекулы.
Ионная проводимость.
Носителями заряда в водных растворах или расплавах электролитов являются положительно и отрицательно заряженные ионы.
Если сосуд с раствором электролита включить в электрическую цепь, то отрицательные ионы начнут двигаться к положительному электроду — аноду, а положительные — к отрицательному — катоду. В результате по цепи пойдёт электрический ток.
Проводимость водных растворов или расплавов электролитов, которая осуществляется ионами, называют ионной проводимостью.
Жидкости могут обладать и электронной проводимостью. Такой проводимостью обладают, например, жидкие металлы.
Электролиз. При ионной проводимости прохождение тока связано с переносом вещества. На электродах происходит выделение веществ, входящих в состав электролитов. На аноде отрицательно заряженные ионы отдают свои лишние электроны (в химии это называется окислительной реакцией), а на катоде положительные ионы получают недостающие электроны (восстановительная реакция).
Жидкости могут обладать и электронной проводимостью. Такой проводимостью обладают, например, жидкие металлы.
Процесс выделения на электроде вещества, связанный с окислительновосстановительными реакциями, называют электролизом.
От чего зависит масса вещества, выделяющегося за определённое время? Очевидно, что масса m выделившегося вещества равна произведению массы m0i одного иона на число Ni ионов, достигших электрода за время Δt:
m = m0iNi. (16.3)
Масса иона m0i равна:
где М — молярная (или атомная) масса вещества, a NA — постоянная Авогадро, т. е. число ионов в одном моле.
Число ионов, достигших электрода, равно:
где Δq = IΔt — заряд, прошедший через электролит за время Δt; q0i — заряд иона, который определяется валентностью n атома: q0i = пе (е — элементарный заряд). При диссоциации молекул, например КВr, состоящих из одновалентных атомов (n = 1), возникают ионы К+ и Вr—. Диссоциация молекул медного купороса ведёт к появлению двухзарядных ионов Си2+ и SO2-4 (n = 2). Подставляя в формулу (16.3) выражения (16.4) и (16.5) и учитывая, что Δq = IΔt, a q0i = nе, получаем
Закон Фарадея.
Обозначим через k коэффициент пропорциональности между массой m вещества и зарядом Δq = IΔt, прошедшим через электролит:
где F = eNA = 9,65 • 104 Кл/моль — постоянная Фарадея.
Коэффициент k зависит от природы вещества (значений М и n). Согласно формуле (16.6) имеем
m = kIΔt. (16.8)
Закон электролиза Фарадея:
Масса вещества, выделившегося на электроде за время Δt. при прохождении электрического тока, пропорциональна силе тока и времени.
Это утверждение, полученное теоретически, впервые было установлено экспериментально Фарадеем.
Величину k в формуле (16.8) называют электрохимическим эквивалентом данного вещества и выражают в килограммах на кулон (кг/Кл).
Из формулы (16.8) видно, что коэффициент к численно равен массе вещества, выделившегося на электродах, при переносе ионами заряда, равного 1 Кл.
Электрохимический эквивалент имеет простой физический смысл. Так как M/NA = m0i и еn = q0i, то согласно формуле (16.7) k = rn0i/q0i, т. е. k — отношение массы иона к его заряду.
Измеряя величины m и Δq, можно определить электрохимические эквиваленты различных веществ.
Убедиться в справедливости закона Фарадея можно на опыте. Соберём установку, показанную на рисунке (16.25). Все три электролитические ванны заполнены одним и тем же раствором электролита, но токи, проходящие через них, различны. Обозначим силы токов через I1, I2, I3. Тогда I1 = I2 + I3. Измеряя массы m1, m2, m3 веществ, выделившихся на электродах в разных ваннах, можно убедиться, что они пропорциональны соответствующим силам токов I1, I2, I3.
Определение заряда электрона.
Формулу (16.6) для массы выделившегося на электроде вещества можно использовать для определения заряда электрона. Из этой формулы вытекает, что модуль заряда электрона равен:
Зная массу m выделившегося вещества при прохождении заряда IΔt, молярную массу М, валентность п атомов и постоянную Авогадро NA, можно найти значение модуля заряда электрона. Оно оказывается равным e = 1,6 • 10-19 Кл.
Именно таким путём и было впервые в 1874 г. получено значение элементарного электрического заряда.
Применение электролиза. Электролиз широко применяют в технике для различных целей. Электролитическим способом покрывают поверхность одного металла тонким слоем другого (никелирование, хромирование, позолота и т. п.). Это прочное покрытие защищает поверхность от коррозии. Если обеспечить хорошее отслаивание электролитического покрытия от поверхности, на которую осаждается металл (этого достигают, например, нанося на поверхность графит), то можно получить копию с рельефной поверхности.
Процесс получения отслаиваемых покрытий — гальванопластика — был разработан русским учёным Б. С. Якоби (1801—1874), который в 1836 г. применил этот способ для изготовления полых фигур для Исаакиевского собора в Санкт-Петербурге.
Раньше в полиграфической промышленности копии с рельефной поверхности (стереотипы) получали с матриц (оттиск набора на пластичном материале), для чего осаждали на матрицы толстый слой железа или другого вещества. Это позволяло воспроизвести набор в нужном количестве экземпляров.
При помощи электролиза осуществляют очистку металлов от примесей. Так, полученную из руды неочищенную медь отливают в форме толстых листов, которые затем помещают в ванну в качестве анодов. При электролизе медь анода растворяется, примеси, содержащие ценные и редкие металлы, выпадают на дно, а на катоде оседает чистая медь.
При помощи электролиза получают алюминий из расплава бокситов. Именно этот способ получения алюминия сделал его дешёвым и наряду с железом самым распространённым в технике и быту.
С помощью электролиза получают электронные платы, служащие основой всех электронных изделий. На диэлектрик наклеивают тонкую медную пластину, на которую наносят особой краской сложную картину соединяющих проводов. Затем пластину помещают в электролит, где вытравливаются не закрытые краской участки медного слоя. После этого краска смывается, и на плате появляются детали микросхемы.
Источник: «Физика — 10 класс», 2014, учебник Мякишев, Буховцев, Сотский
Электрический ток в различных средах — Физика, учебник для 10 класса — Класс!ная физика
Электрическая проводимость различных веществ. Электронная проводимость металлов — Зависимость сопротивления проводника от температуры. Сверхпроводимость — Электрический ток в полупроводниках. Собственная и примесная проводимости — Электрический ток через контакт полупроводников с разным типом проводимости. Транзисторы — Электрический ток в вакууме. Электронно-лучевая трубка — Электрический ток в жидкостях. Закон электролиза — Электрический ток в газах. Несамостоятельный и самостоятельный разряды — Плазма — Примеры решения задач по теме «Электрический ток в различных средах»
class-fizika.ru
1.14.2. Законы электролиза Фарадея
а). Первый закон электролиза
Масса вещества (m), выделившаяся на электроде, прямо пропорциональна электрическом заряду (q), прошедшему через электролит.
m = kq или m = kIt, (1.52)
(поскольку q = It, где I — сила тока, протекающего через раствор электролита за время t, где k — электрохимический эквивалент вещества.
Электрохимический эквивалент вещества численно равен массе вещества, которая осаждается на электроде при прохождении тока через электролит единицы количества электричества (единичный заряд).
б). Второй закон электролиза
Электрохимический эквивалент вещества прямо пропорционален отношению молярной массы к валентности n.
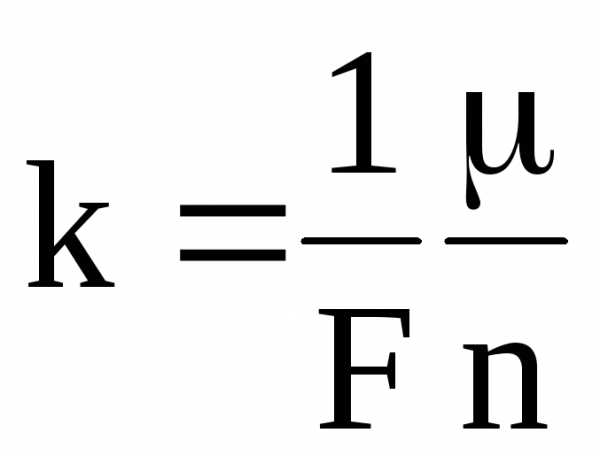 ,
(1.53)
,
(1.53)
где F = 9,648104 Кл/моль — число Фарадея.
в). Объединенный закон электролиза Фарадея
Первый и второй законы электролиза можно объединить. Тогда получаем
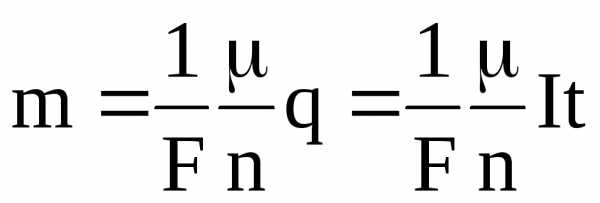 (1.54)
(1.54)
Из объединенного закона электролиза Фарадея следует, что число Фарадея численно равно электрическому заряду, прошедшему через электролит при выделении на электроде массы (кг) вещества, равной отношению /n.
1.15. Понятие о плазме
Подавляющая часть вещества нашей Вселенной находится в состоянии плазмы.
Плазмой называют ионизированный газ с высокой концентрацией заряженных частиц, обладающих свойством квазинейтральности.
Квазинейтральность плазмы заключается в том, что в достаточно большом объеме плазмы количество положительных и отрицательных зарядов практически одинаково. Отношение числа ионизированных атомов к их полному числу в том же объеме называют степенью ионизации плазмы . Если степень ионизации 103, то вещество относят к плазме. В плазменном состоянии находится вещество галактик, звезд, межзвездной среды и т. п., в которых сосредоточена почти вся масса наблюдаемой Вселенной. В звездах молекулы ионизируются в результате тепловых столкновений. Температура внутри нашего Солнца — типичной звезды — составляет 1,5107 К, что соответствует кинетической энергии kT = 2,721016 Дж и намного превышает энергию, необходимую для ионизации любой молекулы (атома), поскольку энергия ионизации молекулы 10191018 Дж. Межзвездный газ превращается в плазму из-за сильной разреженности; его плотность 10201026 кг/м3. Плазма существует и в непосредственной близости от земной поверхности. Так, ионосфера — внешний слой земной атмосферы состоит из сильно ионизированного газа. За ионосферой расположена магнитосфера, в которой находятся радиационные пояса Земли, внутренний и внешний, заполненные заряженными частицами, в основном электронами и протонами различных энергий. Основное качественное отличие слабо ионизированного газа от плазмы проявляется в поведении местных нарушений нейтральности среды, возникает за счет тепловых флуктуаций. В газе такие нарушения, после возникновения, развиваются беспорядочно и могут заполнить весь объем. В плазме же флуктуационные нарушения нейтральности всегда жестко локализованы в достаточно малом объеме. Так как масса ионов значительно больше массы электронов, то более подвижными в плазме являются электроны. Допустим, что область нарушения электронейтральности образуется в некотором слое небольшой толщины х (рис. 1.10, а).
Рис. 1.10
При его смещении, например, вправо относительно такого же слоя ионов на расстояние х (рис. 1.10 б), слой (типа плоского конденсатора) с поверхностной плотностью заряда = qen, где qe — заряд электрона; n — концентрация электронов. Возникает двойной заряженный слой. Между обкладками такого “плазменного” конденсатора возникает электрическое поле напряженности 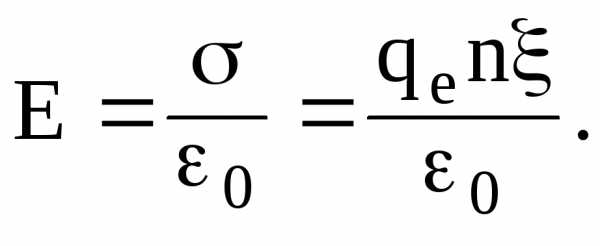 (1.55)
(1.55)
Если площадь обкладок S, тогда внутри конденсатора находится nxS электронов. На них будет действовать кулоновская сила
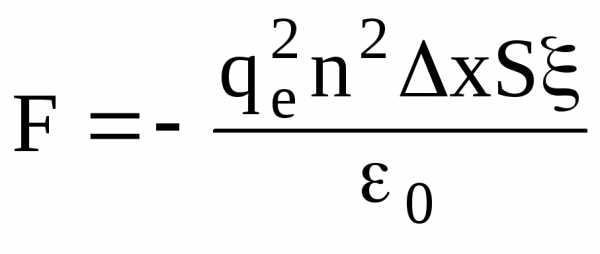 .
(1.56)
.
(1.56)
Масса всех электронов m = menxS, а ускорение их движения
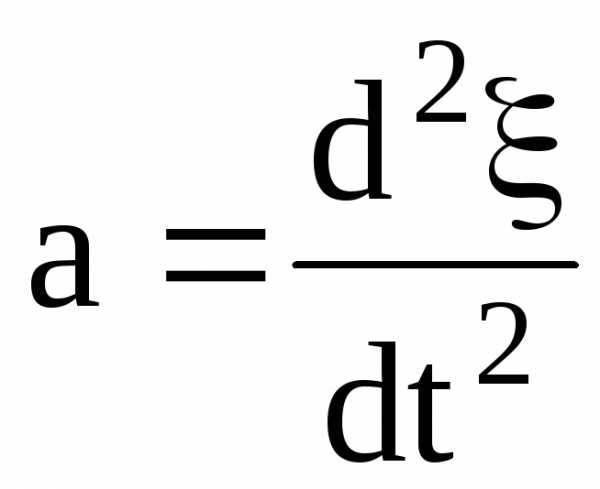 .
.
Согласно второму закону Ньютона
или 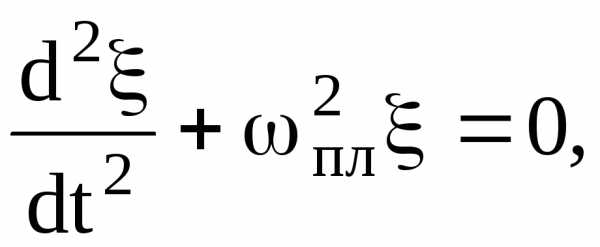 (1.57)
(1.57)
где
menxS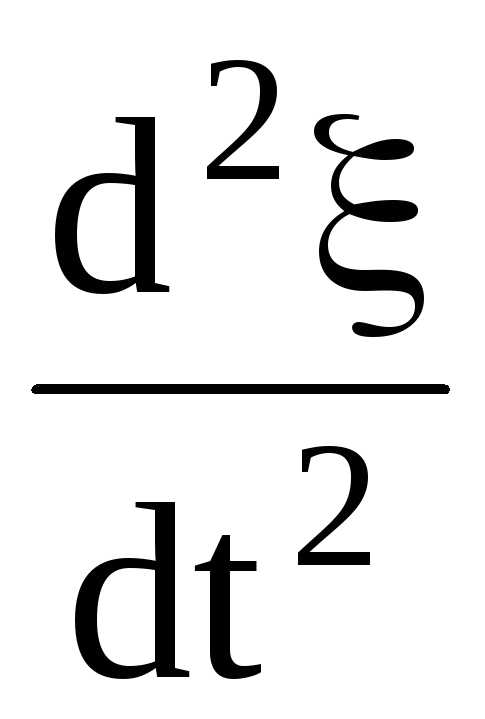 =
=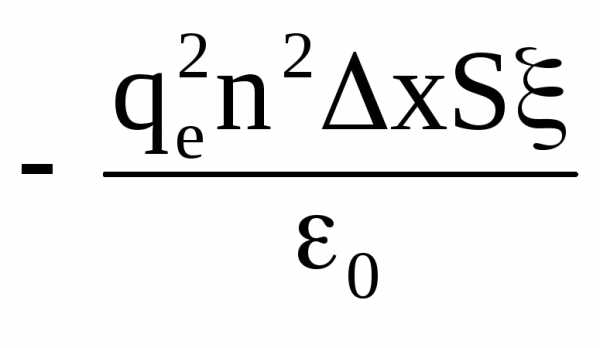 ,
(1.58)
,
(1.58)
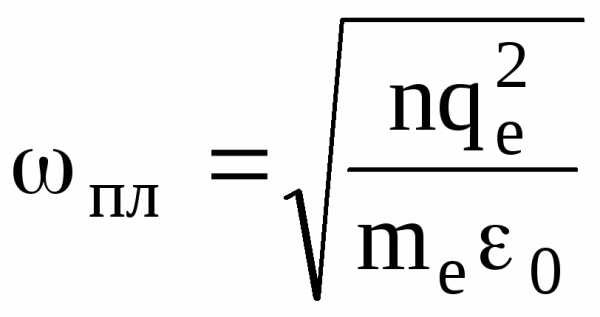 .
(1.59)
.
(1.59)
Колебания, описываемые формулой (1.59 ), называют плазменными. пл — плазменная частота.
Вывод: При нарушении электронейтральности в какой-либо области плазмы в ней возникают гармонические колебания плотности заряда с частотой пл. Но плазменные колебания не имеют волнового характера, т. е. нарушение электронейтральности не распространяется по плазме.
Характерное время существования нарушения электронейтральности плазмы в лабораторных условиях 1013с tпл 103с. Учет столкновений ионов и электронов (друг с другом и с нейтральными молекулами) приводит к затуханию плазменных колебаний. Характерный размер областей, в которых можно наблюдать флуктуационные нарушения электронейтральности, определяется дебаевским радиусом (размером)
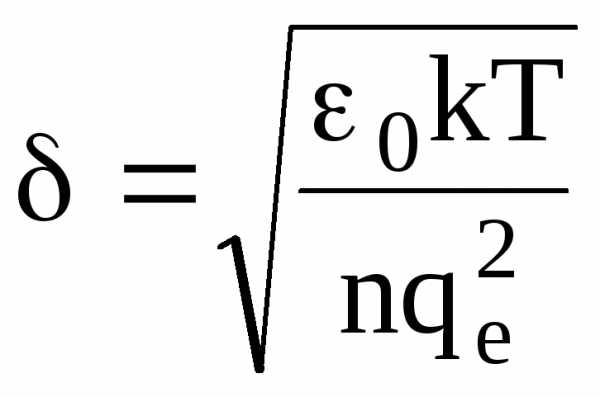 ,
(1.60)
,
(1.60)
который можно найти из условия равенства энергии плазменных колебаний одного электрона и тепловой энергии, приходящейся на одну степень свободы электрона, т. е. kT. Дебаевский размер для наиболее распространенных видов плазмы на несколько порядков превосходит размер атомов или молекул.
Следовательно, в плазме несущественны квантовые эффекты и ее поведение описывается законами классической физики.
Если в плазму ввести пробный, например, положительный заряд +q0, то расположенные по соседству электроны будут им притягиваться, а положительные ионы, наоборот, отталкиваться. В результате вокруг положительного заряда возникает сферически симметричное отрицательно заряженное облако. Оно будет экранировать действие заряда q0 на расположенную вокруг плазму, которая возникает в результате суперпозиции поля положительного заряда q0 и поля, отрицательно заряженного окружающего его облака. Поэтому на некотором удалении от заряда q0 поле, образованное такой суперпозицией, будет исчезающе мало. Это расстояние и определяется дебаевским радиусом экранирования. Плазму экранируюет также и внешнее электрическое поле на расстоянии порядка дебаевского размера.
Полученные результаты справедливы для плазмы, находящейся в состоянии термодинамического равновесия. На практике такое состояние не наблюдается. Поэтому средние кинетические энергии для электронов и ионов оказываются различными, т. е. температура электронов Те и температура ионов Тi не равны, причем Те>Тi. Для равновесной плазмы Те = Тi. При значении ионной температуры Тi<105 K плазму называют низкотемпературной, а при Тi>106 K — высокотемпературной. В плазме взаимодействует большое число частиц. Этим она резко отличается от газов. Средняя потенциальная энергия взаимодействия частиц плазмы мала по сравнению с их кинетической энергией. Поэтому тепловое движение частиц в плазме и идеальном газе имеет большое сходство. Термодинамические свойства плазмы с хорошей степенью точности описываются уравнением состояния идеального газа. Таким образом, плазма представляет собой идеальный газ, состоящий из двух противоположно заряженных частиц — ионов и электронов. Плазменные колебания — упорядоченное движение зарядов подобно звуку в веществе. Это движение дополняет тепловое движение, участвуя в котором каждая заряженная частица плазмы перемещается по плавно извивающейся линии, так как импульс каждой из них меняется в зависимости от времени очень медленно. Наличие в плазме заряженных частиц объясняет ее хорошую электропроводность. Время релаксации плазменных электронов , определяется как среднее время, за которое движение электрона теряет свою упорядоченность, т. е.
. (1.61)
Поэтому удельная электропроводность плазмы
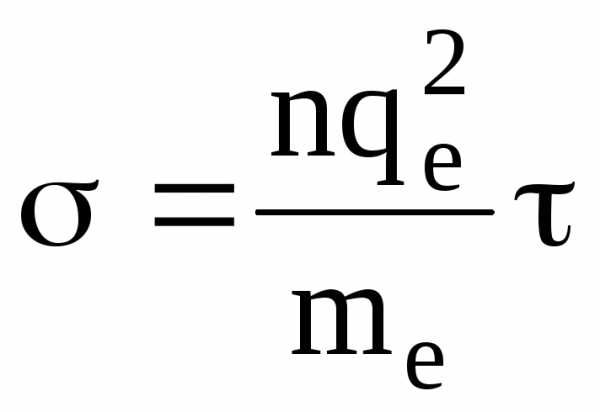 (1.62)
(1.62)
или
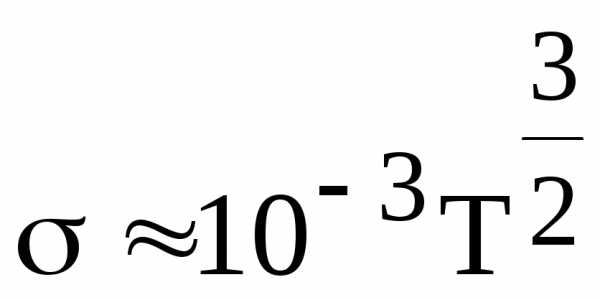 1/(Омм).
(1.63)
1/(Омм).
(1.63)
Удельная электропроводность плазмы слабо зависит от концентрации носителей, так как в ней столкновения носителей практически не играют роли. Температурная зависимость удельной электропроводности плазмы растет пропорционально Т3/2.
Следовательно, достаточно разогретая плазма является хорошим проводником.
Например, при температурах Т 108 К, достигаемых в установках для термоядерных реакций, удельная электропроводность плазмы имеет значения порядка 109 1/(Омм), что на порядок превышает проводимость лучших металлических проводников.
При внесении плазмы в магнитное поле электроны и ионы начинают двигаться по винтовой линии, закручивающейся вокруг силовых линий магнитного поля с частотой для электрона
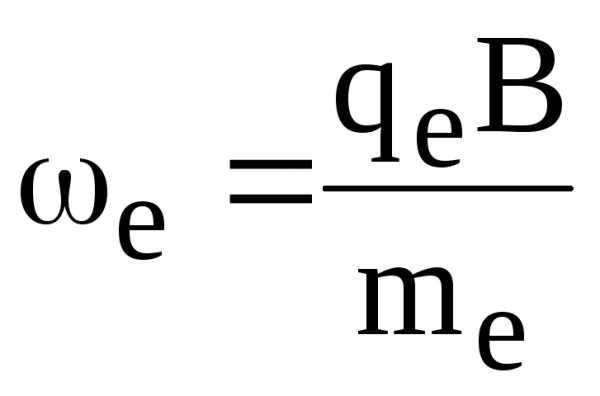 (1.64)
(1.64)
и для иона
, (1.65)
где В — индукция магнитного поля.
Способность магнитного поля удерживать плазму от растекания используется в установках для осуществления термоядерного синтеза в высокотемпературной водородной плазме при Т 108 К.
studfiles.net
Законы электролиза Фарадея
Первый закон Фарадея
Как уже известно, при электролизе на электродах происходит выделение вещества. Попробуем выяснить, от чего будет зависеть масса это вещества. Масса выделившегося вещества m будет равна произведению массы одного иона m0i на число ионов Ni, которые достигли электрода за промежуток времени равный ∆t: m = m0i*Ni. Масса иона m0i будет вычисляться по следующей формуле:
где М — молярная масса вещества, а Na — постоянная Авогадро.
Число ионов, которые достигнут электрода, вычисляется по следующей формуле:
где ∆q = I*∆t — заряд, прошедший через электролит за время, равное ∆t, q0i — заряд иона.
Для того, чтобы определить заряд иона, используется следующая формула:
где n — валентность, e — элементарный заряд.
Собирая воедино все представленные формулы, получаем формулу для вычисления массы выделившегося на электроде вещества:
Теперь обозначим через k коэффициент пропорциональности между массой вещества и зарядом ∆q.
Этот коэффициент k будет зависеть от природы вещества. Тогда формулу массы вещества можно переписать в следующем виде:
Второй закон Фарадея
Масса вещества, выделившегося на электроде за время, равное ∆t, при прохождении электрического тока пропорциональна силе тока и времени. Коэффициент k называют электрохимическим эквивалентом данного вещества. Единицей измерения служит кг/Кл. Разберемся с физическим смыслом электрохимического эквивалента. Так как:
то формулу электрохимического эквивалента можно переписать в следующем виде:
Таким образом, k — отношение массы иона к заряду этого иона.
Для того, чтобы удостовериться в справедливости закона Фарадея, можно провести опыт. Лабораторная установка, необходимая для него, показана на следующем рисунке.
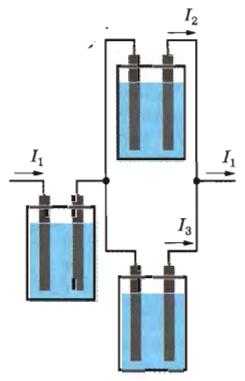
Все три емкости заполнены одинаковым электролитическим раствором. Через них будут протекать различные электрические токи, причем I1 = I2+I3. После включения установки в цепь подождем некоторое время. Потом отключим её и измерим массы веществ, выделившихся на электродах в каждом из сосудов m1, m2, m3. Можно будет убедиться, что массы веществ будут пропорциональны силам тока, которые проходили через соответствующий сосуд.
Из формулы
можно выразить значение заряда электрона
Если посчитать по этой формуле, мы получим значение e = 1.6*10^(-19) Кл.
Именно таким способом было впервые получено значение элементарного электрического заряда.
Нужна помощь в учебе?
Предыдущая тема: Электрический ток в жидкостях: ионная проводимость и электролиз
Следующая тема:   Электрический ток в газах: опыт и проводимость газа
Все неприличные комментарии будут удаляться.
www.nado5.ru
